题目内容
12.配平下面化学方程式,回答下列问题:①3C+2K2Cr2O7+8H2SO4═2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
②在上述反应中氧化剂是K2Cr2O7.
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.8L.
分析 ①反应中K2Cr2O7→Cr2(SO4)3,Cr元素化合价由+6价降低为+3价,共降低6价,而C→CO2,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故K2Cr2O7系数为2,碳的系数为3,再根据原子守恒配平;
②所含元素化合价降低的反应为氧化剂;
③根据转移电子,结合C元素化合价变化计算二氧化碳物质的量,再根据V=nVm计算二氧化碳体积.
解答 解:①反应中K2Cr2O7→Cr2(SO4)3,Cr元素化合价由+6价降低为+3价,共降低6价,C→CO2,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故K2Cr2O7系数为2,碳的系数为3,由Cr原子守恒可知,Cr2(SO4)3的系数为1,由C原子守恒可知CO2的系数为3,根据K原子守恒,可知K2SO4的系数为2,由硫原子守恒可知H2SO4的系数为8,由H原子守恒可知水的系数为8,氧原子守恒,故配平后方程式为:3C+2K2Cr2O7+8H2SO4═2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O,
故答案为:3;2;8;2;3;2;8;
②反应中Cr元素化合价由K2Cr2O7中+6价降低为Cr2(SO4)3中+3价,故K2Cr2O7是氧化剂,
故答案为:K2Cr2O7;
③根据转移电子,可知二氧化碳物质的量为$\frac{0.8mol}{2}$=0.4mol,故标况下生成二氧化碳体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48.
点评 本题考查氧化还原反应配平、基本概念与计算,难度不大,注意掌握化学方程式配平常用方法.

练习册系列答案
相关题目
20.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,向两个烧杯中分别加入1mol两种金属充分反应后,天平依然平衡,则这两种金属是( )
| A. | Mg和Al | B. | Al和Fe | C. | Fe和Cu | D. | Na和Mg |
7.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 6.5g金属Zn与过量的硫酸反应,硫酸无论浓稀,转移电子数均为0.2Na | |
| B. | 含有1mol FeCl3的溶液中阴离子数等于3NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | Na2S和Na2O2 固体混合物15.6g中,含有的阴离子数为0.3NA |
4.某药物中间体的合成路线如下.下列说法正确的是( )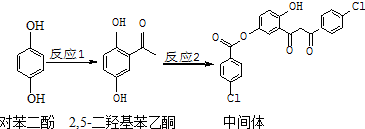

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
1.下列反应的离子方程式正确的是( )
| A. | 纯碱溶液中加入苯酚:CO32-+ → → +HCO3- +HCO3- | |
| B. | 小苏打溶液中加醋酸溶液:HCO3-+CH3COOH→CO2↑+CH3COO- | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH-→AlO2-+2H2O | |
| D. | 氯化铵溶于水:NH4++2H2O?H3O++NH3•H2O |
2.下列装置所示的实验,能达到实验目的是( )


| A. | 用装置A分离乙酸和乙酸乙酯 | B. | 用装置B收集NO气体 | ||
| C. | 用装罝C在实验室中制取氨气 | D. | 用装置D除去Cl2中的HC1 |