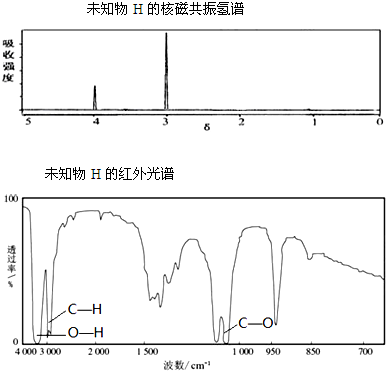
题目内容
10.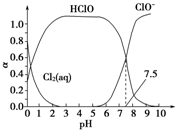 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
| A. | 由图象可知:Ka=10-7.5 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)>c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,杀菌效果最佳pH范围为3~6 | |
| D. | 往氯气-氯水体系中加少量碳酸钙,可提高体系漂白性 |
分析 A.根据图象知,HClO?H++ClO-中pH=7.5,此时c(HClO)=c(ClO-),Ka=$\frac{c({H}^{+})c(Cl{O}^{-})}{c(HClO)}$;
B.任何电解质溶液中都存在电荷守恒;
C.HClO的杀菌能力比ClO-强,所以HClO的浓度越大,其杀菌效果越好,由图象可知,pH=3-6时HClO浓度最大;
D.Cl2(aq)+H2O?HClO+H++Cl- 存在化学平衡,加入碳酸钙,和溶液中盐酸反应促进平衡正向进行,次氯酸浓度增大;
解答 解:A.根据图象知,HClO?H++ClO-中pH=7.5,此时c(HClO)=c(ClO-),Ka=$\frac{c({H}^{+})c(Cl{O}^{-})}{c(HClO)}$=$\frac{1{0}^{-7.5}×c(Cl{O}^{-})}{c(HClO)}$=10-7.5,故A正确;
B.体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),pH=7.5时,根据图可知c(HClO)=c(ClO-),所以,c(Cl-)+c(HClO)=c(H+)-c(OH-),故B错误;
C.起杀菌作用的是HClO,由图象可知,pH=3-6时HClO浓度最大,杀菌效果好,杀菌效果最佳pH范围为3~6,故C正确;
D..Cl2(aq)+H2O?HClO+H++Cl- 存在化学平衡,加入碳酸钙,和溶液中盐酸反应促进平衡正向进行,次氯酸浓度增大,可提高体系漂白性,故D正确;
故选B.
点评 本题以氯水为载体考查了化学平衡常数的计算、离子浓度大小比较、物质的稳定性等知识点,正确分析图象中各个物理量的关系是解本题关键,再结合盖斯定律、物质的性质等知识点来分析解答,题目难度中等.

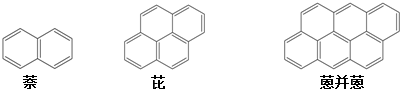
| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
| A. | 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫 | |
| C. | 用氯化铵溶液除去铁锈 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
| A. | 32 S | B. | 4 He | C. | 14 N | D. | 32 Si |
| A. | ⅥA族元素的原子半径越大,越容易得到电子 | |
| B. | I A族与VIIA族元素间能形成离子化合物也能形成共价化合物 | |
| C. | I A族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族 |

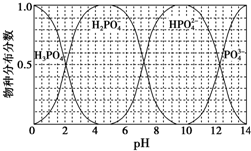 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.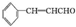 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: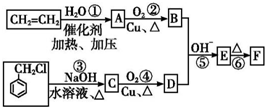

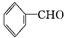 ;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.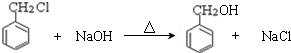 .
.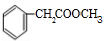 .
.