题目内容
1.下列关于元素周期表和元素周期律的说法正确的是( )| A. | ⅥA族元素的原子半径越大,越容易得到电子 | |
| B. | I A族与VIIA族元素间能形成离子化合物也能形成共价化合物 | |
| C. | I A族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族 |
分析 A、同主族元素从上到下金属性增强,失去电子能力增强;
B.I A族与VIIA族元素间能形成离子化合物,也能形成共价化合物;
C.不同周期的元素金属性强弱不一定,例如钙的金属性强于锂等;
D.可能是0族的He或是过渡元素等;
解答 解:A、因同主族元素从上到下原子半径子增大,金属性在增强,失去电子能力增强,故A错误;
B.I A族与VIIA族元素间能形成离子化合物,例如氯化钠,也能形成共价化合物例如氯化氢等,故B正确;
C.同周期I A族元素的金属性比ⅡA族元素的金属性强,不同周期的元素金属性强弱不一定,例如钙的金属性强于锂等,故C错误;
D.原子最外层电子数为2的元素不一定位于元素周期表中的ⅡA族,也可能是0族的He或是过渡元素等,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律,熟悉元素性质的变化规律及单质的性质、过渡元素的分布即可解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和11.2L O2 | D. | 224mL H2(标准状况下)和0.1mol N2 |
10.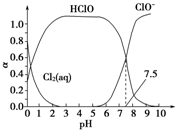 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
③HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述不正确的是( )
| A. | 由图象可知:Ka=10-7.5 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)>c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,杀菌效果最佳pH范围为3~6 | |
| D. | 往氯气-氯水体系中加少量碳酸钙,可提高体系漂白性 |
7.下列有机反应属于加成反应的是( )
| A. | (CH3)2C=O+HCN→(CH3)2C(OH)CN | B. | CH3CH2OH→CH2=CH2↑+H2O | ||
| C. | 2CH3CHO+O2→2CH3COOH | D. | CHCl3+HF→CHFCl2+HCl |
14.下列反应不能用勒夏特列原理解释的是( )
| A. | 电解水时加入Na2SO4溶液 | |
| B. | 向K2Cr2O7溶液中滴加MaOH溶液后变黄色 | |
| C. | 石灰岩雨水溶蚀形成溶洞 | |
| D. | 用TiCl4与水反应制备TiO2 |
13.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和1mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
10. Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
 Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )| A. | 电池工作时,K+向负极移动 | |
| B. | 电池工作时,Al电极周围溶液pH增大 | |
| C. | 电池工作时,电子由Al经溶液流向Ni | |
| D. | 正极反应为MnO4-+2H2O+3e-═MnO2+4OH- |
11.关于CF2Cl2 (商品名为氟里昂-12)的叙述正确的是( )
| A. | 属于卤代烃 | B. | 有两种同分异构体 | ||
| C. | 所有原子在同一平面上 | D. | 能发生消去反应 |
 ③
③ ⑤
⑤ .
.