题目内容
14.相同温度、相同浓度的六种电解质溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是( )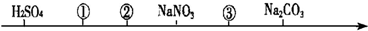
| A. | CH3COOH HCl CH3COONa | B. | HCl CH3COOH NaHCO3 | ||
| C. | NH4Cl CH3COOH NaOH | D. | NH4Cl HCl CH3COONa |
分析 硫酸是强酸,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是酸,②是盐,③溶液呈碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子.
解答 解:硫酸是强酸,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是酸,②是盐,③溶液呈碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子,
A.醋酸的电离程度小于氯化氢,故A错误;
B.氯化氢的电离程度大于醋酸,碳酸氢根离子的水解程度小于碳酸根离子,所以符合图象,故B正确;
C.醋酸的电离程度大于氯化铵的水解程度,所以等浓度的醋酸溶液酸性大于氯化铵,故C错误;
D.氯化氢的电离程度大于氯化铵的水解程度,所以等浓度的盐酸溶液酸性大于氯化铵,故D错误;
故选B.
点评 本题考查了弱电解质的电离、盐类的水解等知识点,题目难度中等,明确等浓度时,酸的强弱与溶液pH的关系、盐类水解程度与溶液pH的关系是解本题关键.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
4.设NA为阿伏加德罗常数,下列说法中不正确的是( )
| A. | 标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/NAg | |
| B. | 加热条件下,20mL10mol/L的浓硝酸与足量铜反应转移电子数为0.1NA | |
| C. | 电解精炼铜的过程中转移了NA个电子,则阴极析出32g铜 | |
| D. | 1L pH=1的硫酸溶液中,含有0.1NA个H+ |
5.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| B. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| C. | 化学反应能够制造出新的物质,同时也能制造出新的元素 | |
| D. | 减少机动车尾气的排放,可以降低雾霾的发生 |
2.下列实验能获得成功的是( )
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量水解液加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
9.相同温度下,相同物质的量浓度的下列溶液:
①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3•H2O,
按pH由大到小顺序排列正确的是( )
①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3•H2O,
按pH由大到小顺序排列正确的是( )
| A. | ⑤①③②④ | B. | ④②③①⑤ | C. | ①⑤③②④ | D. | ①⑤③④② |
19.实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
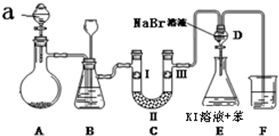
(1)a仪器的名称是:分液漏斗.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2).和浓盐酸,写出反应的化学反应方程式Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.

(1)a仪器的名称是:分液漏斗.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2).和浓盐酸,写出反应的化学反应方程式Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
3.下列说法正确的是( )
| A. | 化合物的名称为2-甲基-5-乙基己烷 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是高分子化合物,一定条件下都能发生水解反应 | |
| C. | 在蛋白质溶液中加入硫酸铜溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |