题目内容
1.下列说法不正确的是( )①放热反应的反应速率总是大于吸热反应的反应速率
②所有的化学反应都伴随着能量变化
③放热反应发生时不必加热,吸热反应在加热后才能发生
④101KPa下1molC(s)和2molC(s)的燃烧热不同
⑤化学反应的热效应数值只与参加反应的物质的多少有关
⑥同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
⑦依据盖斯定律,反应焓变的大小与反应的途径有关.
| A. | 除②外 | B. | 全部 | C. | ③⑤⑦ | D. | ①③④⑤⑦ |
分析 ①反应速率是单位时间内物质浓度变化计算,与吸热放热无直接关系;
②化学反应的过程是旧键断裂,新键形成的过程,成键、断键都有能量变化;
③化学反应发生的条件与反应的热效应无关;
④燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量;
⑤化学反应的热效应数值与参加反应的物质的多少、物质的状态等有关;
⑥反应的焓变只和反应物生成物的能量有关,与反应途径、条件无关;
⑦盖斯定律实质是化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
解答 解:①反应速率是单位时间内物质浓度变化计算,与吸热放热无直接关系,放热反应的反应速率不一定大于吸热反应的反应速率,故①错误;
②化学反应的过程是旧键断裂,新键形成的过程,成键、断键都有能量变化,所以说任何化学反应都有能量变化,故②正确;
③有些放热反应需要加热才能发生,如:铝热反应需在高温下反应,有些吸热反应不需要任何条件即可发生,如氯化铵和氢氧化钡晶体在常温下反应,故③错误;
④燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量,与可燃物的多少无关,故④错误;
⑤化学反应的热效应数值与参加反应的物质的多少、物质的状态等有关,故⑤错误;
⑥△H=Q(生成物的能量和)-Q(反应物的能量和),与反应途径、反应条件无关,故⑥错误;
⑦依据盖斯定律,反应焓变的大小与反应的途径无关,无论是一步完成还是分几步完成,其总的热效应完全相同,故⑦错误;
故选A.
点评 本题考查了化学反应的条件与化学反应的热效应间的关系,盖斯定律内容等,难度不大,需正确理解放热、吸热的本质是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13. 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
对该分子的下列叙述,不正确的是( )
 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:对该分子的下列叙述,不正确的是( )
| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
12.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
9.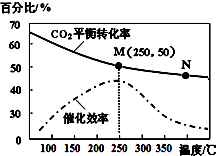 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
16.下列溶液一定显酸性的是( )
| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
13.下列说法中,不正确的是( )
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
10.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
11.实验:
①0.005mol•L-1 FeCl3溶液和0.015mol•L-1 KSCN溶液各1mL混合得到红色溶液
a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol•L-1 NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol•L-1 KSCN溶液2mL,溶液颜色先变深后变浅.
下列分析不正确的是( )
①0.005mol•L-1 FeCl3溶液和0.015mol•L-1 KSCN溶液各1mL混合得到红色溶液
a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol•L-1 NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol•L-1 KSCN溶液2mL,溶液颜色先变深后变浅.
下列分析不正确的是( )
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
 某有机物X的键线式为
某有机物X的键线式为 .
. ,
, .
. .
.