题目内容
18.下列实验中,所选装置不合理的是( )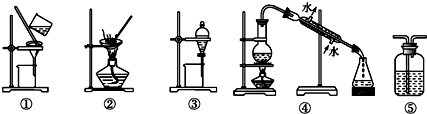
| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |
分析 由图可知,①②③④⑤分别为过滤、蒸发、萃取(或分液)、蒸馏、洗气装置,
A.氯化亚铁和氯气反应生成氯化铁;
B.Na2CO3溶液和油脂分层;
C.碘不易溶于水,易溶于四氯化碳;
D.粗盐提纯,需要溶解后过滤、蒸发得到NaCl.
解答 解:A.氯化亚铁和氯气反应生成氯化铁,则选⑤长进短出可吸收,故A正确;
B.Na2CO3溶液和油脂分层,则选择③,故B错误;
C.碘不易溶于水,易溶于四氯化碳,则用CCl4萃取碘水中的碘,选③,故C正确;
D.粗盐提纯,需要溶解后过滤、蒸发得到NaCl,则选①和②,故D正确.
故选B.
点评 本题考查化学实验方案的评价,涉及混合物分离提纯,为高频考点,把握实验装置的作用、混合物分离方法及原理为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
8.为了减少CO对大气的污染,某学习小组拟研究CO和H2O反应转化为绿色能源H2
(1)已知:2CO(g)+O2(g)═2CO2(g);△H=-566kJ•moL-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6KJ•moL-1
H2O (g)═H2O(l);△H=-44.0KJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(2)在850℃时,反应:CO(g)+H2O(g)?CO2(g)+H2(g)的K=1.
①:若升高温度到950℃时,达到平衡时K<1(填“>”、“<”或“=”).
②:850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是x<3.
③:在②的条件下,按下列加料方式加料,达到平衡时H2的体积分数如下:
则:a=b(填“>”、“<”或“=”).
(3)H2是一种理想的绿色能源,可作燃料电池.
①若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是O2+4e-+2H2O═4OH-
②在25℃时,以氢氧燃料电池为电源,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28g Cu生成.试回答下列问题:
电解的总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
电解过程中转移的电子数为0.08mol,同时生成标准状况下气体的体积为0.896L.
(1)已知:2CO(g)+O2(g)═2CO2(g);△H=-566kJ•moL-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6KJ•moL-1
H2O (g)═H2O(l);△H=-44.0KJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(2)在850℃时,反应:CO(g)+H2O(g)?CO2(g)+H2(g)的K=1.
①:若升高温度到950℃时,达到平衡时K<1(填“>”、“<”或“=”).
②:850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是x<3.
③:在②的条件下,按下列加料方式加料,达到平衡时H2的体积分数如下:
| 加料方式(mol) | H2的体积分数 | ||||
| 物质 | CO(g) | H2O(g) | CO2(g) | H2(g) | |
| 加料一 | 1 | 3 | 0 | 0 | a% |
| 加料二 | 0 | 1.2 | 0.6 | 0.6 | b% |
(3)H2是一种理想的绿色能源,可作燃料电池.
①若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是O2+4e-+2H2O═4OH-
②在25℃时,以氢氧燃料电池为电源,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28g Cu生成.试回答下列问题:
电解的总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
电解过程中转移的电子数为0.08mol,同时生成标准状况下气体的体积为0.896L.
9.有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
3.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )


| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
8.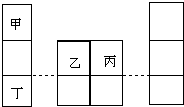 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )| A. | 简单离子半径:r(丁)>r(乙)>r(丙) | |
| B. | 元素丙的简单气态氢化物的热稳定性比乙的强 | |
| C. | 仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性 | |
| D. | 丙和丁形成的两种化合物中阴阳离子个数比不同 |

 (或
(或
 ).
). ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.