题目内容
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2?L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3,下列叙述正确的是( )
| A、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| B、向2.0×10-4mol?L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol?L-1 AgNO3溶液,则有Ag2CrO4沉淀生成 |
| C、将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 |
| D、将0.001 mol?L-1的AgNO3溶液逐滴滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、AgCl的Ksp只与温度有关,与离子的浓度有关;
B、计算溶液中的Q与Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3比较;
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少.
B、计算溶液中的Q与Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3比较;
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少.
解答:
解:A、AgCl的Ksp只与温度有关,向AgCl的浊液中加入氯化钠溶液,虽然平衡向逆方向移动,但Ksp不变,故A错误;
B、Q=c2(Ag+)×c(CrO42-)=(
)2×
=1.0×10-12<Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3,所以没有沉淀生成,故B错误;
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子,所以银离子浓度最大,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=
=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=
=4.36×10-5 mol/L,故先产生AgCl沉淀,故D正确;
故选D.
B、Q=c2(Ag+)×c(CrO42-)=(
| 2.0×10-4 |
| 2 |
| 2.0×10-4 |
| 2 |
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子,所以银离子浓度最大,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=
| Ksp(AgCl) |
| c(Cl-) |
|
故选D.
点评:本题考查溶度积常数的有关计算、判断离子是否完全,沉淀等问题,综合性强,难度较大.

练习册系列答案
相关题目
下列物质不属于合金的是( )
| A、水银 | B、青铜 | C、生铁 | D、碳素钢 |
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )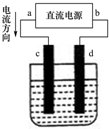

| A、电解过程中,d电极质量增加 |
| B、d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| C、a为负极、b为正极 |
| D、电解过程中,氯离子浓度不变 |
将pH=13的强碱溶液与pH=2的强酸溶液混合后,pH=11,则强碱与强酸的体积比为( )
| A、11:1 | B、9:1 |
| C、1:1 | D、1:9 |
强弱电解质的本质区别是( )
| A、导电能力 | B、化学键的类型 |
| C、溶解度 | D、电离程度 |
将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )
| A、9:1 | B、18:7 |
| C、41:9 | D、1:1 |
下列关于各图象的解释或结论正确的是( )
A、.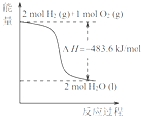 热化学方程式是H2(g)+
| ||
B、.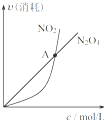 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | ||
C、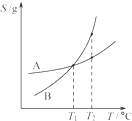 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | ||
D、.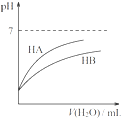 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 |
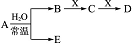 已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).
已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).