题目内容
6. 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)的△H=-268.3kJ•mol-1.NOx主要来源于汽车尾气.
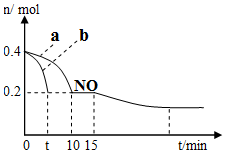
(1)T℃时,模拟汽车尾气催化转化:2NO+2CO?2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=5(mol/L)-1;平衡时若保持温度不变,再向容器中充入0.2mol CO和0.4mol N2,平衡将向右移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是b(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是增加CO的物质的量浓度或增大压强.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为Ⅱ>Ⅲ>Ⅰ.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:H2O+2SO2+CO32-═2HSO3-+CO2↑.
(3)已知NaHSO3溶液显酸性,下列说法正确的是D.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
分析 ①2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
③2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1,$\frac{1}{2}×①$+$\frac{1}{2}×②$-③得,2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)△H=-268.3kJ•mol-1,据此进行分析;
(1)①起始时,NO为4mol,平衡时NO为0.2mol,根据方程式求出平衡时CO、CO2、N2的浓度,根据平衡常数表达式计算;根据Qc与k的相对大小分析;
②催化剂表面积较大,反应速率快,达到平衡所用时间短;
③由图象可知,NO的浓度减小,平衡向正方向移动;
(2)①电解质溶液:I、Na2CO3 溶液中碳酸根离子水解显碱性,II、NaHCO3 溶液中碳酸氢根离子水解显碱性,III、Na2SO3 亚硫酸根离子水解显碱性,依据阴离子水解程度分析判断;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳;
(3)A.据物料守恒分析,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3);
B.根据电荷守恒分析,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-);
C.NaHSO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-);
解答 解:①2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
③2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1,$\frac{1}{2}×①$+$\frac{1}{2}×②$-③得,2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)△H=-268.3kJ•mol-1,
故答案为:-268.3kJ•mol-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO?2CO2+N2
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.{1}^{2}×0.05}{0.{1}^{2}×0.{1}^{2}}$=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.{1}^{2}×0.45}{0.{1}^{2}×0.{5}^{2}}$=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡移动和平衡常数的计算、电解原理的应用,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力,注意把握三段式在化学平衡计算中的应用.

| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
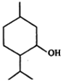
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)将含1mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:HCO3-+OH-=CO32-+H2O.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水.
(5)若向含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为233g.
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是A.A.HClB.HBrC.HI
(3)Cl2+H2=2HCl 的反应是B反应.A.吸热反应B.放热反应.