题目内容
7.薄荷醇的结构简式如图,下列说法正确的是( )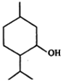
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
分析 有机物含有羟基,可发生取代、氧化和消去反应,结合环烃的结构解答该题.
解答 解:A.含有饱和碳原子,具有烷烃的结构特点,则12个原子不可能在同一平面上,故A错误;
B.由结构简式可知分子式为C10H20O,与环己醇结构相似,互为同系物,故B正确;
C.薄荷醇不能和碳酸氢钠反应,故C错误;
D.含有羟基,不具有酸性,不能发生中和反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力考查,有利于培养学生的良好的科学素养,注意把握有机的组成、结构和性质,难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
17.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
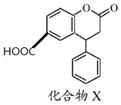

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
18.25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |
15.下列事实与水解反应无关的是( )
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
2.大苏打是五水合硫代硫酸钠(Na2S2O3•5H2O)的俗称,又称海波,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.向Na2CO3和Na2S混合溶液中通入SO2反应后制得Na2S2O3•5H2O,通常制得的产品含有少量Na2SO3和Na2SO4.
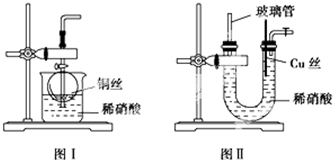
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):
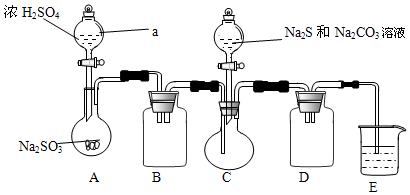
实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
(5)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
6. 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:
2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)的△H=-268.3kJ•mol-1.NOx主要来源于汽车尾气.
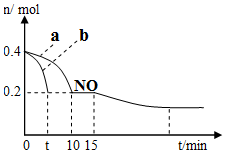
(1)T℃时,模拟汽车尾气催化转化:2NO+2CO?2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=5(mol/L)-1;平衡时若保持温度不变,再向容器中充入0.2mol CO和0.4mol N2,平衡将向右移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是b(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是增加CO的物质的量浓度或增大压强.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
回答下列问题:
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为Ⅱ>Ⅲ>Ⅰ.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:H2O+2SO2+CO32-═2HSO3-+CO2↑.
(3)已知NaHSO3溶液显酸性,下列说法正确的是D.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)的△H=-268.3kJ•mol-1.NOx主要来源于汽车尾气.
(1)T℃时,模拟汽车尾气催化转化:2NO+2CO?2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=5(mol/L)-1;平衡时若保持温度不变,再向容器中充入0.2mol CO和0.4mol N2,平衡将向右移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是b(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是增加CO的物质的量浓度或增大压强.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为Ⅱ>Ⅲ>Ⅰ.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:H2O+2SO2+CO32-═2HSO3-+CO2↑.
(3)已知NaHSO3溶液显酸性,下列说法正确的是D.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
7.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
( )
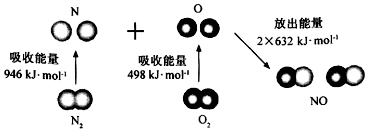
( )

| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.