题目内容
14.水体污染的治理是化学工作者研究的重要课题.(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去.
已知 NH4++HClO═NH2Cl+H++H2O△H=a kJ?mol-1
2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ?mol-1
NH4++4HClO═NO3-+6H++4Cl-+H2O△H=c kJ?mol-1
则 2NH4++3HClO═N2+3H2O+5H++3Cl-△H=2a+bkJ?mol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟.
①电解时,阳极的电极反应式为2Cl--2e-=Cl2↑.电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示.
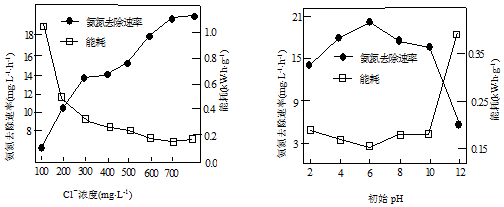
②图1中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是阳极可能OH-放电,产生大量氧气,消耗电能;而当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$.
③图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是pH太低时,产生的Cl2会从溶液中逸出.
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去.写出该反应的离子方程式:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O.
(4)废水中的重金属离子通常用沉淀法除去.已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol•L-1,铜低于7.8×10-5mol•L-1.则需要控制溶液中S2-的浓度不低于10-16mol•L-1.
分析 (1)①NH4++HClO═NH2Cl+H++H2O△H=a kJ?mol-1
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ?mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ?mol-1;
(2)①阳极失去电子发生氧化反应;
②据4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能来分析;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$;
③据pH太低时,产生的Cl2会从溶液中逸出来分析;
(3)漂白粉的有效成分是Ca(ClO)2,并据题意书写离子方程式;
(4)依据溶度积常数计算不同沉淀下的硫离子浓度.
解答 解:(1))①NH4++HClO═NH2Cl+H++H2O△H=a kJ?mol-1
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ?mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ?mol-1;
故答案为:2a+b;
(2)①阳极失去电子发生氧化反应,故电极反应方程式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
②氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是:Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$,
故答案为:阳极可能OH-放电,产生大量氧气,消耗电能;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$;
③当pH过低时,处理效果不佳的原因可能是,pH太低时,产生的Cl2会从溶液中逸出,
故答案为:pH太低时,产生的Cl2会从溶液中逸出;
(3)漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O,
故答案为:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O;
(4)Ksp(NiS)=c(Ni+)c(S2-)=1.1×10-21,则c(S2-)=$\frac{Ksp(NiS)}{c(N{i}^{+})}$=$\frac{1.1×1{0}^{-21}}{1.1×1{0}^{-5}}$=10-16mol•L-1,Ksp(CuS)=c(Cu2+)c(S2-)
=1.3×10-36,c(S2-)=$\frac{Ksp(CuS)}{c(C{u}^{2+})}$=$\frac{1.3×1{0}^{-36}}{7.8×1{0}^{-5}}$=1.7×10-32mol•L-1,1.7×10-32mol•L-1<10-16mol•L-1,故则需要控制溶液中S2-的浓度不低于10-16mol•L-1,
故答案为:10-16.
点评 本题考查反应热的计算,电极反应方程式及离子方程式的书写,以及溶度积常数的计算等,本题难度中等.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
①第一份加过量NaOH溶液后加热,收集到0.01mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到11.65g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:2CO(g)+O2(g)?CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)?SO3(g)+2NO(g)+CO2(g)的△H=-268.3kJ•mol-1.NOx主要来源于汽车尾气.
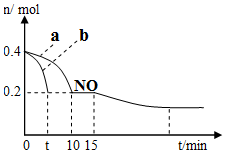
(1)T℃时,模拟汽车尾气催化转化:2NO+2CO?2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=5(mol/L)-1;平衡时若保持温度不变,再向容器中充入0.2mol CO和0.4mol N2,平衡将向右移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是b(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是增加CO的物质的量浓度或增大压强.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为Ⅱ>Ⅲ>Ⅰ.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:H2O+2SO2+CO32-═2HSO3-+CO2↑.
(3)已知NaHSO3溶液显酸性,下列说法正确的是D.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
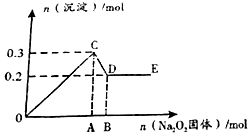
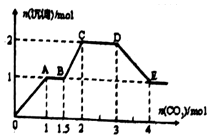 现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是Ba2+、Na+、Cl-、NH4+ | |
| B. | 肯定不存在的离子是Cl-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为:0.2mol/L | |
| D. | OA段反应的离子方程式::2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
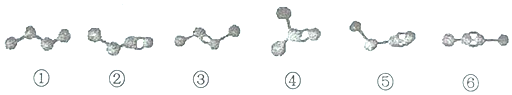
| A. | 烃②、③、④的分子式均为C4H8,三者互为同分异构体 | |
| B. | 烃⑤和⑥的分子式均为C4H6,二者互为同分异构体 | |
| C. | 烃②、③、⑤、⑥分别与足量氧气发生加成反应,均可得到烃① | |
| D. | 等物质的量的烃②和⑤分别在氧气中完全燃烧,烃⑤消耗的氧气多 |
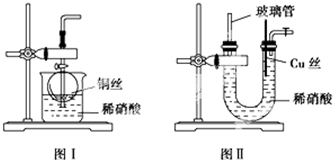
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.