题目内容
4.下列化学用语使用正确的组合是( )①氘表示为12D
②乙炔的分子结构模型示意图:

③有机还原剂LiAlH4中,氢显-1价
④质量为40的钙原子:4020Ca
⑤NH4Cl的电子式:
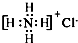
⑥2-甲基丁醇的结构简式:
| A. | ①②③ | B. | ③④ | C. | ②④⑤ | D. | ①④⑥ |
分析 ①氕氘氚是氢元素的同位素,质子数相同为1,中子数不同,质量数分别为1、2、3,原子符号表示是质量数标在元素符号左上角,质子数标在元素符号左下角;
②乙炔的分子中存在碳碳三键,为直线型结构;
③有机还原剂LiAlH4中,根据锂的化合价为+1、Al的化合价为+3价判断氢元素的化合价④该钙原子的核电荷数为20,质量数为40;
⑤氯化铵的电子式中氯离子的最外层电子式没有标出;
⑥根据醇的命名原则进行判断,甲醇的命名中,编号从距离官能团羟基最近的一端开始.
解答 解:①氘为氢的一种稳定形态同位素,也被称为重氢,元素符号一般为D或2H,原子不能表示为12D,故①错误;
②乙炔为直线型,乙炔的分子结构模型示意图为: ,故②错误;
,故②错误;
③有机还原剂LiAlH4中,锂的化合价为+1、铝的化合价为+3,则氢显-1价,故③正确;
④质量数为40的钙原子可表示为:2040Ca,故④正确;
⑤NH4Cl为离子化合物,阴阳离子需要标出所带荷,铵根离子和氯离子还应该标出最外层电子,氯化铵正确的电子式为: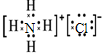 ,故⑤错误;
,故⑤错误;
⑥ 为3-甲基-1-丁醇,2-甲基-1-丁醇的结构简式为:CH3CH2CH(CH3)CH2OH,故⑥错误;
为3-甲基-1-丁醇,2-甲基-1-丁醇的结构简式为:CH3CH2CH(CH3)CH2OH,故⑥错误;
故选B.
点评 本题考查了比例模型、电子式、离子结构示意图、结构简式等判断,题目难度中等,试题涉及的题量稍大,注意明确常见的化学用语的概念及正确表示方法.

练习册系列答案
相关题目
12.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应符合“绿色化学”理念的是( )
| A. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| B. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| C. | 制CuSO4:2Cu+O2═2CuO; Cu+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O |
9.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙烷(乙烯) | 酸性KMnO4溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(甲苯) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
16.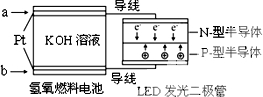 LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
 LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | 该装置将化学能最终转化为电能 | |
| B. | a处通入O2 | |
| C. | b处为电池正极,发生还原反应 | |
| D. | 通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O |
13.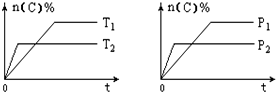 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )| A. | 使用催化剂,C的物质的量分数增加 | |
| B. | 升高温度,平衡向正反应方向移动 | |
| C. | 化学方程式的系数a<c+d | |
| D. | 根据图象无法确定改变温度后平衡移动方向 |
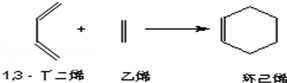
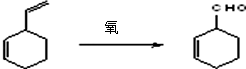
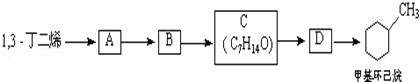
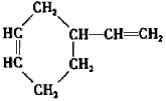 ;B
;B
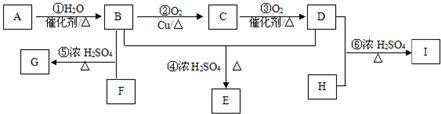
 .
.