题目内容
13.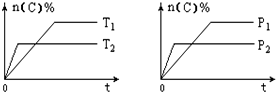 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )| A. | 使用催化剂,C的物质的量分数增加 | |
| B. | 升高温度,平衡向正反应方向移动 | |
| C. | 化学方程式的系数a<c+d | |
| D. | 根据图象无法确定改变温度后平衡移动方向 |
分析 催化剂改变反应速率不改变化学平衡,可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即a<c+d,据此结合外界条件对化学平衡的影响分析解答.
解答 解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即a<c+d;
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;
B、正反应为放热反应,升温平衡逆向移动,故B错误;
C、压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即a<c+d,故C正确;
D、T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应,升温平衡逆向移动,可以判断,故D错误;
故选C.
点评 本题考查化学平衡图象问题,题目难度中等,注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列化学用语使用正确的组合是( )
①氘表示为12D
②乙炔的分子结构模型示意图:
③有机还原剂LiAlH4中,氢显-1价
④质量为40的钙原子:4020Ca
⑤NH4Cl的电子式: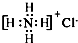
⑥2-甲基丁醇的结构简式: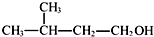
①氘表示为12D
②乙炔的分子结构模型示意图:

③有机还原剂LiAlH4中,氢显-1价
④质量为40的钙原子:4020Ca
⑤NH4Cl的电子式:
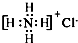
⑥2-甲基丁醇的结构简式:
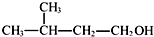
| A. | ①②③ | B. | ③④ | C. | ②④⑤ | D. | ①④⑥ |
1.下列说法正确的是( )
| A. | 新制的氯水保存在无色玻璃瓶中 | |
| B. | 氢气在氯气中燃烧生成白色烟雾 | |
| C. | 常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 | |
| D. | 向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
8.根据下图海水综合利用的工业流程图,判断下列说法正确的是
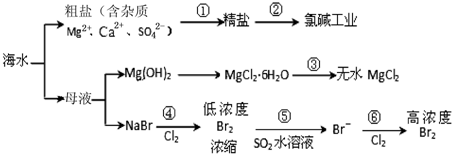
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
18.下列由实验数据或现象得出的结论正确的是( )
| 实验操作 | 实验数据或现象 | 结论 | |
| A | 用PH计分别测定SO2和CO2饱和溶液的PH | 前者PH小 | H2SO3酸性强于H2CO3 |
| B | 向Ag Cl悬浊液中加入NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向滴用酚酞的氨水中加入少量CH3COONH4固体 | 溶液红色变浅 | 氨水中存在电离平衡 |
| D | 等体积、等PH的HA和HB两种酸溶液分别与足量的锌反应 | 相同时间内,HA酸产生的氢气多 | HA是强酸 |
| A. | A | B. | B | C. | C | D. | D |
5.分子式为C5H12O的醇与C4H8O2的羧酸在浓H2SO4存在时共热生成的酯有( )
| A. | 6种 | B. | 16种 | C. | 32种 | D. | 12种 |

 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.