题目内容
18.亚硝酸氯(C1NO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)?2C1NO(g),(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
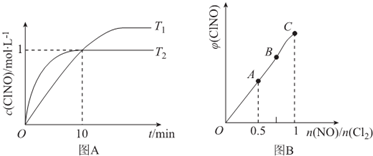
①由图A可判断T1<T2,该反应的△H<0 (填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min).
③T2时该反应的平衡常数K=2.
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点.
分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;
(3)①由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),结合速率之比等于化学计量数之比计算;
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
结合平衡浓度计算该反应的平衡常数K;
(4)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),则平衡常数K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$,故答案为:K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,
故答案为:289-2a;
(3)①根据图象可知T1<T2,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0,
故答案为:<;<;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),
则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K=$\frac{{1}^{2}}{{1}^{2}×0.5}$=2,
故答案为:2;
(4)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大,NO的转化率最大的是A点,
故答案为:A.
点评 本题考查化学平衡的计算,为高频考点,把握K的计算、三段法应用、焓变的计算为解答的关键,侧重分析与计算能力的考查,注意图象及数据的应用,题目难度不大.

| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 加碘食盐中所加的“碘”一般是碘化钾或碘单质 | |
| C. | 区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应 | |
| D. | 用干燥的有色布条可以检验氯化氢气体中是否混有氯气 |
 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
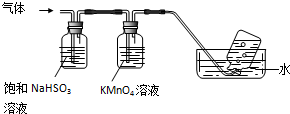
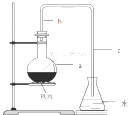 中学实验室用如图所示装置制取少量溴苯.请填写下列空白.
中学实验室用如图所示装置制取少量溴苯.请填写下列空白.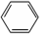 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$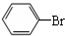 +HBr.
+HBr.