题目内容
8.配平下列反应的化学方程式□KMnO4+□SO2+□H2O═□K2SO4+□MnSO4+□H2SO4
其中,反应中转移5mole-,则消耗SO22.5 mol.
分析 反应中高锰酸钾中的锰元素由+7价降为+2价,二氧化硫中的硫元素由+4价升高为+6价,依据氧化还原反应中得失电子守恒规律结合原子个数守恒规律配平书写方程式,依据方程式判断转移电子数与消耗二氧化硫关系.
解答 解:反应中高锰酸钾中的锰元素由+7价降为+2价,二氧化硫中的硫元素由+4价升高为+6价,要使得失电子守恒,则高锰酸钾系数为2,二氧化硫系数为5,依据原子个数守恒,方程式:5SO2 +2KMnO4+2H2O=K2SO4 +2MnSO4+2H2SO4,依据方程式每反应5mol二氧化硫,转移电子数为5mol×(6-4)=10mol电子,所以反应中转移5mole-,则消耗SO2物质的量为2.5mol;
故答案为:2;5;2;1;2;2;2.5mol.
点评 本题考查了氧化还原反应的配平,明确氧化还原反应得失电子守恒规律、电子转移数目的计算方法是解题关键,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
18.亚硝酸氯(C1NO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)?2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+C12(g)?2C1NO(g)反应的△H和a的关系为△H=289-2akJ/mol.
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
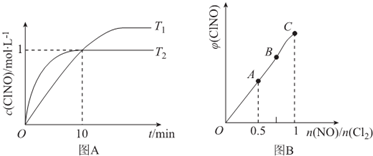
①由图A可判断T1<T2,该反应的△H<0 (填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min).
③T2时该反应的平衡常数K=2.
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①由图A可判断T1<T2,该反应的△H<0 (填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min).
③T2时该反应的平衡常数K=2.
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点.
19.下列关于钠及其化合物的说法错误的是( )
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠可用作呼吸面具和潜水艇中做氧气的来源 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
16.下列分离方法中不正确的是( )
| A. | 利用萃取方法用四氯化碳提取溴水中的溴单质 | |
| B. | 利用蒸馏的方法可以分离沸点相差较大的液体混合物 | |
| C. | 利用分液的方法分离酒精和水 | |
| D. | 利用结晶的方法除去KNO3中的氯化钾 |
3.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是电解质
②酸、碱、盐都是强电解质
③0.5mol•L-1 所有一元酸中氢离子浓度都是0.5mol•L-1
④电解质在通电情况下才能发生电离
⑤电解质溶液导电的原因是在溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
①不溶于水的盐(CaCO3、BaSO4等)都是电解质
②酸、碱、盐都是强电解质
③0.5mol•L-1 所有一元酸中氢离子浓度都是0.5mol•L-1
④电解质在通电情况下才能发生电离
⑤电解质溶液导电的原因是在溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑤⑥ |
13.下列离子方程式书写正确的是( )
| A. | 铜跟浓硝酸反应:3Cu2+ 8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| B. | 大理石与醋酸反应:2H++CO32-═CO2↑+H2O | |
| C. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
17.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| C. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
 2,2二甲基丁烷.
2,2二甲基丁烷. 2,3二甲基戊烷.
2,3二甲基戊烷. 2,4二甲基己烷.
2,4二甲基己烷.