题目内容
10. 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
分析 由图可知,X的浓度从开始到5min时一直在减少,第5min时,浓度不再发生变化,则该反应达到平衡状态,
A.结合v=$\frac{△c}{△t}$计算;
B.平衡时各物质的浓度不变;
C.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
D.物质的量与反应中热量变化成正比.
解答 解:A.由图可知,2min内,X的浓度变化量为0.9mol/L-0.4mol/L=0.5mol/L,则X的平均反应速率为$\frac{0.5mol/L}{2min}$=0.25mol/(L•min),故A正确;
B.第5min时,X的物质的量浓度不再变化,该反应达到平衡状态,故B正确;
C.第5min后,为平衡状态,Y与X的化学计量数之比为4:1,则Y的生成速率的4倍与X的生成速率相等且保持不变,故C错误;
D.5min内参加反应的X为2L×(0.9mol/L-0.1mol/L)=1.6mol,结合热化学方程式可知1molX反应放热为QkJ,则反应放出的热量为1.6QkJ,故D正确;
故选C.
点评 本题考查物质的量浓度随时间的变化曲线,为高频考点,把握图中物质的量浓度的变化、平衡状态的判断及特征、反应中能量变化等为解答的关键,侧重分析与应用能力的考查,注意图象的分析与应用,题目难度不大.

练习册系列答案
相关题目
17.下列分离、提纯、鉴别物质的方法正确的是( )
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| C. | 用溶解、过滤的方法分离K2MnO4和MnO2固体的混合物 | |
| D. | 用分液的方法分离煤油和汽油 |
18.亚硝酸氯(C1NO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)?2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+C12(g)?2C1NO(g)反应的△H和a的关系为△H=289-2akJ/mol.
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
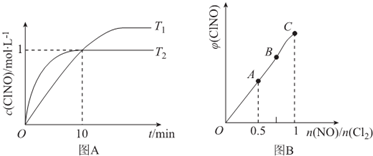
①由图A可判断T1<T2,该反应的△H<0 (填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min).
③T2时该反应的平衡常数K=2.
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①由图A可判断T1<T2,该反应的△H<0 (填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min).
③T2时该反应的平衡常数K=2.
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点.
15. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
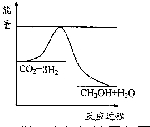
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2 和3mol H2.
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2 和3mol H2.
2.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 | |
| D. | 在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
19.下列关于钠及其化合物的说法错误的是( )
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠可用作呼吸面具和潜水艇中做氧气的来源 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
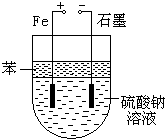 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
 .
. 2,2二甲基丁烷.
2,2二甲基丁烷. 2,3二甲基戊烷.
2,3二甲基戊烷. 2,4二甲基己烷.
2,4二甲基己烷.