题目内容
下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”),作此判断的理由是 .
(2)25℃下,某Na2SO4溶液中c(SO
)=5×10-4mol?L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)= .
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-浓度为c(OH-)水= .
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 (mol2?L-2) | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a
(2)25℃下,某Na2SO4溶液中c(SO
2- 4 |
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-浓度为c(OH-)水=
考点:水的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)水是弱电解质,存在电离平衡,电离吸热;
(2)硫酸钠溶液是显中性的;
(3)氢氧化钠抑制水的电离.
(2)硫酸钠溶液是显中性的;
(3)氢氧化钠抑制水的电离.
解答:
解:(1)水是弱电解质,存在电离平衡,电离吸热;所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;温度升高,水的电离程度增大,离子积增大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1;
(3)在t2℃下,pH=10的NaOH溶液,cc(H+)=1×10-10 mol/L,水电离产生的OH-浓度为c(OH-)水=c(H+)水=1×10-10 mol/L,
故答案为:1×10-10 mol/L.
故答案为:>;温度升高,水的电离程度增大,离子积增大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1;
(3)在t2℃下,pH=10的NaOH溶液,cc(H+)=1×10-10 mol/L,水电离产生的OH-浓度为c(OH-)水=c(H+)水=1×10-10 mol/L,
故答案为:1×10-10 mol/L.
点评:本题考查考查水的电离、水的离子积常数和pH的有关计算,题目难度中等,注意水的离子积常数与温度有关.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
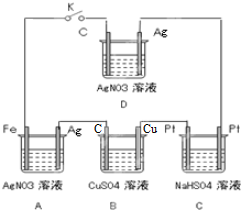
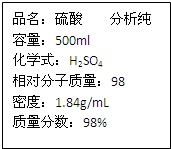 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题: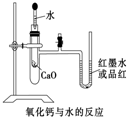 如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
 现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图:
现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图: