题目内容
依据事实,写出下列反应的热化学方程式.
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22kJ.则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收17kJ热量 .
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量 .
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22kJ.则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收17kJ热量
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;根据1g甲醇燃烧生成CO2和液态水时放热22kJ,计算1mol甲醇燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(2)根据每生成23克NO2需要吸收17kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(3)2mol乙炔反应转移20NA个电子,根据每有5NA个电子转移时,放出650kJ的热量,计算2mol乙炔燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题.
(2)根据每生成23克NO2需要吸收17kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(3)2mol乙炔反应转移20NA个电子,根据每有5NA个电子转移时,放出650kJ的热量,计算2mol乙炔燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题.
解答:
解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22kJ,32g甲醇燃烧生成CO2和液态水时放热22kJ×32=704kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热704KJ,所以燃烧热的热化学方程式为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H=-704kJ/mol,
故答案为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H=-704kJ/mol;
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收17kJ热量,所以每生成92克NO2需要吸收68kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol;
(3)2mol乙炔反应转移20NA个电子,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有20NA个电子转移时,放出2600kJ的热量,则热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ/mol,
故答案为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ/mol.
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收17kJ热量,所以每生成92克NO2需要吸收68kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol;
(3)2mol乙炔反应转移20NA个电子,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有20NA个电子转移时,放出2600kJ的热量,则热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ/mol,
故答案为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ/mol.
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

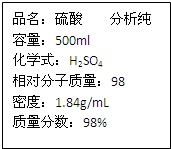 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
 现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图:
现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图: