题目内容
实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A.烧杯 B.100mL量筒 C.100mL容量瓶 D.药匙 E.玻璃棒 F.天平
(1)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 .该试验中两次用到玻璃棒,其作用分别是 , .
(2)应用托盘天平称取十水碳酸钠晶体的质量为 ,若加蒸馏水不慎超过刻度线,处理的方法是 .
(3)若实验遇下列情况,溶液的浓度是偏高、偏低还是不变.
A.溶解后没有冷却便进行定容 ;
B.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀 ;
C.定容时俯视容量瓶的标线 ;
D.容量瓶内壁附有水珠而未干燥处理 .
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为 (设溶液的体积变化可忽略).
A.烧杯 B.100mL量筒 C.100mL容量瓶 D.药匙 E.玻璃棒 F.天平
(1)配制时,必须使用的仪器有
(2)应用托盘天平称取十水碳酸钠晶体的质量为
(3)若实验遇下列情况,溶液的浓度是偏高、偏低还是不变.
A.溶解后没有冷却便进行定容
B.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀
C.定容时俯视容量瓶的标线
D.容量瓶内壁附有水珠而未干燥处理
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
考点:溶液的配制
专题:实验题
分析:(1)根据配置一定物质的量浓度溶液的步骤去分析所需仪器及其规格;溶解时,玻璃棒搅拌促进溶解,转移时引流;
(2)通过n(Na2CO3)=0.100mol/L×0.5L=0.05mol,则需要十水碳酸钠晶体为0.05mol,然后计算其质量;若加蒸馏水不慎超过刻度线,会导致所配溶液浓度偏低,应重新配制;
(3)分析操作对溶质物质的量n、溶液体积V的影响,根据c=
判断操作对所配溶液浓度的影响;
(4)根据溶液稀释前后溶质的量不变,进行计算.
(2)通过n(Na2CO3)=0.100mol/L×0.5L=0.05mol,则需要十水碳酸钠晶体为0.05mol,然后计算其质量;若加蒸馏水不慎超过刻度线,会导致所配溶液浓度偏低,应重新配制;
(3)分析操作对溶质物质的量n、溶液体积V的影响,根据c=
| n |
| V |
(4)根据溶液稀释前后溶质的量不变,进行计算.
解答:
解:(1)实验室配制460mL0.100mol/LNa2CO3溶液,称量时需要天平,溶解时需要药匙、烧杯、玻璃棒,还缺少500ml容量瓶、胶头滴管,以完成后面的转移、定容等;溶解时,玻璃棒搅拌促进溶解,转移时引流,
故答案为:ADEF;500mL容量瓶、胶头滴管;搅拌促进溶解;引流;
(2)n(Na2CO3)=0.100mol/L×0.5L=0.05mol,则需要十水碳酸钠晶体为0.05mol,其质量为0.05mol×286g/mol=14.3g;若加蒸馏水不慎超过刻度线,会导致所配溶液浓度偏低,应重新配制,
故答案为:14.3g;重新配制;
(3)A.溶解后没有冷却便进行定容,导致溶解后的液体体积偏大,则定容时所加水减少,浓度偏高;
B.摇匀后发现液面低于标线,对浓度无影响,滴加蒸馏水至标线再摇匀,导致浓度偏低;
C.定容时俯视容量瓶的标线,导致加水的体积偏少,浓度偏高;
D.容量瓶内壁附有水珠而未干燥处理,由于定容时需要加水,所以干不干燥容量瓶对浓度无影响;
故答案为:偏高;偏低;偏高;不变;
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
=0.175 mol/L,
故答案为:0.175 mol/L.
故答案为:ADEF;500mL容量瓶、胶头滴管;搅拌促进溶解;引流;
(2)n(Na2CO3)=0.100mol/L×0.5L=0.05mol,则需要十水碳酸钠晶体为0.05mol,其质量为0.05mol×286g/mol=14.3g;若加蒸馏水不慎超过刻度线,会导致所配溶液浓度偏低,应重新配制,
故答案为:14.3g;重新配制;
(3)A.溶解后没有冷却便进行定容,导致溶解后的液体体积偏大,则定容时所加水减少,浓度偏高;
B.摇匀后发现液面低于标线,对浓度无影响,滴加蒸馏水至标线再摇匀,导致浓度偏低;
C.定容时俯视容量瓶的标线,导致加水的体积偏少,浓度偏高;
D.容量瓶内壁附有水珠而未干燥处理,由于定容时需要加水,所以干不干燥容量瓶对浓度无影响;
故答案为:偏高;偏低;偏高;不变;
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为
| 0.1×50+0.2×150 |
| 200 |
故答案为:0.175 mol/L.
点评:本题考查了一定物质的量浓度溶液的配制及误差分析等,题目难度一般,根据c=
理解溶液的配制与误差分析,注意容量瓶要带着规格,注意提高计算结果的准确性.
| n |
| V |

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
 和
和
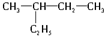 和
和 
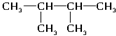 和
和 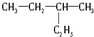
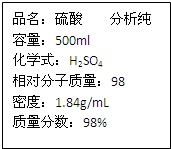 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题: