题目内容
 为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验:
为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验:(1)实验中酸均为0.1mol?L-1 100mL,则镁带的质量至少为
(2)铜丝不能接触酸溶液的原因
(3)本实验中验证盐酸和醋酸酸性不同的思路是
考点:比较强弱电解质的实验,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据盐酸或者醋酸的物质的量及化学方程式进行计算;根据反应反应方程式及酸的物质的量计算出产生氢气的体积,然后选择量筒规格;
(2)根据镁与铜易形成原电池,加快反应速率,干扰实验测定分析;
(3)相同条件下,反应速率快的,说明溶液中氢离子浓度大,酸性较强.
(2)根据镁与铜易形成原电池,加快反应速率,干扰实验测定分析;
(3)相同条件下,反应速率快的,说明溶液中氢离子浓度大,酸性较强.
解答:
解:(1)Mg+2HCl(或HAc)═MgCl2+H2↑
24g 2 mol
m 0.1mol/L×0.1L
m=
=0.12 g,
Mg+2HCl(或HAc)═MgCl2+H2↑
2mol 1mol
0.1mol/L×0.1L n(H2)
n(H2)=
=0.005 mol,V(H2)=0.005 mol×22.4L/mol=0.112L=112mL,应选200mL量筒,
故答案为:0.12;200;
(2)若铜丝与酸接触,镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:防止铜、镁与酸形成原电池,干扰实验现象的观察;
(3)验证盐酸和醋酸酸性不同的思路为:在外界条件相同的情况下,同浓度的盐酸和醋酸中,反应速率快的,说明溶液中氢离子浓度大,其酸性强,
故答案为:在外界条件相同的情况下,反应速率快的说明[H+]大,酸性强.
24g 2 mol
m 0.1mol/L×0.1L
m=
| 24g×0.1mol/l×0.1L |
| 2mol |
Mg+2HCl(或HAc)═MgCl2+H2↑
2mol 1mol
0.1mol/L×0.1L n(H2)
n(H2)=
| 0.1mol/L×0.1L×1mol |
| 2mol |
故答案为:0.12;200;
(2)若铜丝与酸接触,镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:防止铜、镁与酸形成原电池,干扰实验现象的观察;
(3)验证盐酸和醋酸酸性不同的思路为:在外界条件相同的情况下,同浓度的盐酸和醋酸中,反应速率快的,说明溶液中氢离子浓度大,其酸性强,
故答案为:在外界条件相同的情况下,反应速率快的说明[H+]大,酸性强.
点评:本题考查了探究酸性强弱的方法,题目难度中等,注意掌握比较电解质强弱的方法,明确探究酸性强弱的实验原理,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
核素
C 的质子数是( )
12 6 |
| A、2 | B、6 | C、12 | D、18 |
已知C(石墨,s)═C(金刚石,s)(吸热反应),P4(白磷,s)═4P(红磷,s)(放热反应),下列判断正确的是( )
| A、说明金刚石的内能比石墨低 |
| B、说明红磷比白磷稳定 |
| C、说明红磷比金刚石稳定 |
| D、此种变化为物理变化 |
下列说法正确的是( )
| A、纯净物是由同一元素组成的物质 |
| B、能导电的物质都是电解质 |
| C、物质的量是一种国际基本物理量 |
| D、摩尔是物质的量的数量单位 |

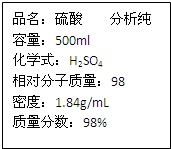 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题: