题目内容
15.某水溶液中可能含有K+、Na+、Fe2+、Fe3+、Al3+、SO42-、ClO-、NO2-、SiO32-、CO32-中的若干种离子.某同学取四份该溶液各10mL进行如下实验:①第一份加入足量稀盐酸,无任何气体和沉淀产生;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色
关于上述实验,下列说法正确的是( )
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
分析 ①第一份加入足量稀盐酸,无任何气体和沉淀产生,则SiO32-、CO32-一定不存在,Fe2+和ClO-不能同时存在;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体三氧化二铁,可以是含有铁离子,所以一定含有Fe3+,根据铁元素守恒,其离子物质的量是$\frac{1.6g}{160g/mol}$×2=0.02mol,一定不存在NO2-;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL,则一定含有Fe2+、一定不含ClO-,根据高锰酸根离子和亚铁离子之间反应的实质可以计算亚铁离子的含量;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色,一定含有Na+,钾离子无法确定.
解答 解:①第一份加入足量稀盐酸,无任何气体和沉淀产生,则SiO32-、CO32-一定不存在,Fe2+和ClO-不能同时存在;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体,所以一定含有Fe3+,物质的量是$\frac{1.6g}{160g/mol}$×2=0.02mol,一定不存在NO2-;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL,则一定含有Fe2+、一定不含ClO-,第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL,根据量的关系,得到5Fe2+~KMnO4,所以亚铁离子的物质的量是0.1mol/L×0.01L×5=0.005mol;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色,一定含有Na+,钾离子无法确定.
综上得到,溶液中一定存在:Na+、Fe2+、Fe3+、SO42-,一定不存在的是:ClO-、NO2-、SiO32-、CO32-,其余的离子无法判断.
A、由实验①②即可推断原混合溶液中一定存在Fe3+,仅有实验②得到的溶液中还可以是亚铁离子和次氯酸根离子同时存在的情况,故A错误;
B、要确定原混合溶液是否含有ClO- 至少需完成实验①②即可,根据实验①②得到存在的铁离子一定是原来存在的铁离子,故B错误;
C、该溶液阳离子中一定存在Na+、Fe2+、Fe3+,无法确定是否含有K+、Al3+,故C错误;
D、该溶液阳离子中一定存在Na+、Fe2+、Fe3+,溶液中阴离子只有SO42-,且根据电荷守恒,SO42-的物质的量大于$\frac{1}{2}$(0.02mol×3+0.005mol×2)=0.035mol,c(SO42-)>$\frac{0.035mol}{0.01L}$=3.5mol/L,级c(SO42-)大于2.75moL/L,故D正确.
故选D.
点评 本题考查物质的检验、鉴别,为高频考点,侧重于学生的分析能力的考查,题目难度中等,解答本题的关键是把握发生的有关化学反应确定存在的离子.

| A. | 设法将太阳光聚焦,产生高温,使水分解产生氢气 | |
| B. | 寻找特殊化学物质,使水分解产生氢气,同时释放能量 | |
| C. | 寻找特殊化学物质,用于开发廉价能源以分解水制取氢气 | |
| D. | 构成水的氢气和氧气都是可燃烧的物质,因此可研究在水不分解的情况下,使氢能成为二级能源 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(3)①元素的某氧化物通常用作供氧剂,请写出它与⑦元素的氧化物反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| A. | 2NA | B. | NA | C. | 1.5NA | D. | 0.5 NA |
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 45.8 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 452 | 488 | 614 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、MnOOH和碳粉,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+$\frac{1}{x}$Sx(s)△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ/mol.
则CO与Sx生成COS反应的热化学方程式是xCO(g)+Sx(s)=xCOS(g)△H=-0.5x(b-a)kJ/mol.
| A. | 钠、干冰 | B. | 金刚石、晶体硅 | ||
| C. | 碘化氢、溴化氢 | D. | 二氧化硅、二氧化碳 |
| A. | AgNO3 | B. | BaCl2 | C. | NaOH | D. | HCl |
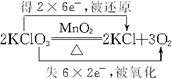 .
.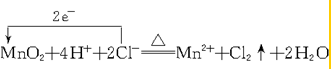 .
.