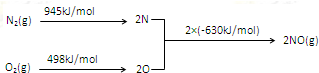
题目内容
3.在反应2Na+2H2O═2NaOH+H2↑中,生成1mol H2时转移电子数目为( )| A. | 2NA | B. | NA | C. | 1.5NA | D. | 0.5 NA |
分析 该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,其转移电子数为2,根据氢气和转移电子之间关系式计算转移电子数.
解答 解:该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,生成1molH2时转移电子物质的量=1mol×2×(1-0)=2mol,转移电子数=2mol×NA/mol=2NA,故选A.
点评 本题考查化学方程式有关计算,为高频考点,明确氢气和转移电子关系式是解本题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.某合作学习小组讨论辨析以下说法:
①漂白粉和水玻璃都是混合物
②SO2和氯水都有漂白性,二者混合后漂白性更强,
③冰和干冰既是纯净物又是化合物
④淀粉和纤维素通式均为(C6H10O5)n,但二者不是同分异构体;
⑤酸性氧化物一定是非金属氧化物
⑥SiO2和硅都是电的良导题,
上述说法正确的是( )
①漂白粉和水玻璃都是混合物
②SO2和氯水都有漂白性,二者混合后漂白性更强,
③冰和干冰既是纯净物又是化合物
④淀粉和纤维素通式均为(C6H10O5)n,但二者不是同分异构体;
⑤酸性氧化物一定是非金属氧化物
⑥SiO2和硅都是电的良导题,
上述说法正确的是( )
| A. | ①②③ | B. | ①②⑤ | C. | ③⑤⑥ | D. | ①③④ |
18.下列说法中正确的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可以有效延长其保持期 | |
| B. | 利用丁达尔效应可区分淀粉溶液和NaCl溶液 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌 | |
| D. | 石油分馏属于化学变化 |
15.某水溶液中可能含有K+、Na+、Fe2+、Fe3+、Al3+、SO42-、ClO-、NO2-、SiO32-、CO32-中的若干种离子.某同学取四份该溶液各10mL进行如下实验:
①第一份加入足量稀盐酸,无任何气体和沉淀产生;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色
关于上述实验,下列说法正确的是( )
①第一份加入足量稀盐酸,无任何气体和沉淀产生;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色
关于上述实验,下列说法正确的是( )
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
12.向某溶液中滴加过量盐酸,生成能使澄清石灰水变浑浊的无色气体,则有关推断不正确的是( )
| A. | 该气体一定是CO2 | |
| B. | 如果该气体无味,则该溶液中可能含CO32- | |
| C. | 如果该气体无味,则该溶液中可能含CO32-、HCO3-或者两者均有 | |
| D. | 如果该气体具有刺激性气味,则该溶液中可能含SO32-、HSO3-或者两者均有 |
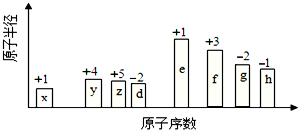 随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.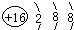 .
.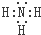 .
.