题目内容
4.只用一种试剂,可区别Na2SO4、MgSO4、FeCl2、AlCl3四种溶液,这种试剂是( )| A. | AgNO3 | B. | BaCl2 | C. | NaOH | D. | HCl |
分析 Na2SO4、MgSO4、FeCl2、AlCl3四种溶液分别与NaOH反应现象为:无现象、产生白色沉淀、白色沉淀变为灰绿色最后为红褐色、先生成白色沉淀后沉淀消失,现象不同,据此分析解答.
解答 解:A.这几种溶液与AgNO3混合都产生白色沉淀,现象相同,无法鉴别,故A错误;
B.Na2SO4、MgSO4与BaCl2混合都产生白色沉淀,现象相同,无法鉴别,故B错误;
C.Na2SO4、MgSO4、FeCl2、AlCl3四种溶液分别与NaOH反应现象为:无现象、产生白色沉淀、白色沉淀变为灰绿色最后为红褐色、先生成白色沉淀后沉淀消失,现象不同,可以鉴别,故C正确;
D.Na2SO4、MgSO4、FeCl2、AlCl3四种溶液与稀盐酸都不反应,无现象,无法鉴别,故D错误;
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,明确物质性质及其性质差异性是解本题关键,注意亚铁离子与氢氧根离子反应现象,题目难度不大.

练习册系列答案
相关题目
15.某水溶液中可能含有K+、Na+、Fe2+、Fe3+、Al3+、SO42-、ClO-、NO2-、SiO32-、CO32-中的若干种离子.某同学取四份该溶液各10mL进行如下实验:
①第一份加入足量稀盐酸,无任何气体和沉淀产生;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色
关于上述实验,下列说法正确的是( )
①第一份加入足量稀盐酸,无任何气体和沉淀产生;
②第二份加入足量NaOH,经搅拌、过滤、洗涤、灼烧,最后得到1.6g红棕色固体;
③第三份加入酸性KMnO4溶液会使其褪色,滴至终点时共消耗0.1mol•L-1酸性KMnO4溶液10.00mL;
④第四份用洁净的铂丝做焰色反应实验,直接观察,火焰呈黄色
关于上述实验,下列说法正确的是( )
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
12.向某溶液中滴加过量盐酸,生成能使澄清石灰水变浑浊的无色气体,则有关推断不正确的是( )
| A. | 该气体一定是CO2 | |
| B. | 如果该气体无味,则该溶液中可能含CO32- | |
| C. | 如果该气体无味,则该溶液中可能含CO32-、HCO3-或者两者均有 | |
| D. | 如果该气体具有刺激性气味,则该溶液中可能含SO32-、HSO3-或者两者均有 |
19.常温下,在下列溶液里,各组离子一定能够大量共存的是( )
| A. | 无色溶液:Na+、K+、SO42-、MnO4- | |
| B. | pH=1的溶液中:Fe2+、SO42-、Cl-、NO3- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+、 | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液:K+、Cl-、Ba2+、Br- |
9.下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是( )
| 选项 | W | X | Y | Z |  |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| C | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | N2 NH3 NO NO2 | B. | Na Na2O2 NaOH Na2CO3 | ||
| C. | Cu CuSO4 CuCl2 Cu(OH)2 | D. | Al Al2(SO4)3 AlCl3 NaAlO2 |
16.下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
(1)自然界物质种类最多的元素在周期表中的位置是第二周期第IV族
(2)⑧⑨⑩的离子半径由大到小的顺序为S2->Cl->Na+(填化学用语).
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式
(4)根据斜线性质相似规则,②的最高价氧化物对应的水化物与盐酸反应的离子方程式LiOH+H+=Li++H2O
(5)③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式Be+2OH-=BeO22-+H2↑
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,写出该反应式NH4++OH-=NH3+H2O.
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |
(2)⑧⑨⑩的离子半径由大到小的顺序为S2->Cl->Na+(填化学用语).
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式

(4)根据斜线性质相似规则,②的最高价氧化物对应的水化物与盐酸反应的离子方程式LiOH+H+=Li++H2O
(5)③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式Be+2OH-=BeO22-+H2↑
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,写出该反应式NH4++OH-=NH3+H2O.
 随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.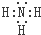 .
.