题目内容
17.化学与生产、生活密切相关,下列说法不正确的是( )| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素( )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
分析 A.合成纤维属于有机化合物;
B.地沟油属于油脂,油脂可发生皂化反应制肥皂;生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇在催化剂作用下,进行酯交换制成的液体燃料;
C.大力实施矿物燃料“脱硫、脱硝技术”,可减少酸雨、光化学烟雾等污染;
D.中国科学家屠呦呦获2015年诺贝尔生理学或医学奖,她的团队从中药中分离出青蒿素应用于疟疾治疗.
解答 解:A.合成纤维属于有机化合物,不是无机非金属材料,光导纤维是新型无机非金属材料,故A错误;
B.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故B正确;
C.大力实施矿物燃料“脱硫、脱硝技术”,可减少酸雨、光化学烟雾等污染,故C正确;
D.中国科学家屠呦呦获2015年诺贝尔生理学或医学奖,她的团队从中药中分离出青蒿素应用于疟疾治疗,已知青蒿素的分子式为C15H22O5,故D正确.
故选A.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
7.在一定体积的密闭容器中进行某化学反应,其平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学方程式为CO2(g)+H2(g)?CO(g)+H2O(g).
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于$\frac{5}{6}$mol.
化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学方程式为CO2(g)+H2(g)?CO(g)+H2O(g).
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于$\frac{5}{6}$mol.
2.以下数值等于阿伏加德罗常数值的是( )
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
9.在体积恒定的密闭容器中,一定量的SO2与1.25mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) $?_{加热}^{催化剂}$2SO3(g)△H<0.当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%.下列有关叙述正确的是( )
| A. | 该温度下的平衡常数为101.25 L/moL | |
| B. | 达到平衡时,SO2的转化率是90% | |
| C. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为231.4g |
6.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如表:
请回答:
(1)不考虑其它组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol•Lˉ1否
(选填“是”或“否”);该混合溶液中离子浓度c(Aˉ)与c(Na+)的大小关系是C;
A.前者大 B.后者大 C.二者相等 D.无法判断
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)=c(A-)=c(OH-)=c(H+);
(3)丁组实验所得混合溶液中,写出下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简).c(Na+)-c(Aˉ)=10-5-10-9 mol•Lˉ1.
请回答:
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
(选填“是”或“否”);该混合溶液中离子浓度c(Aˉ)与c(Na+)的大小关系是C;
A.前者大 B.后者大 C.二者相等 D.无法判断
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)=c(A-)=c(OH-)=c(H+);
(3)丁组实验所得混合溶液中,写出下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简).c(Na+)-c(Aˉ)=10-5-10-9 mol•Lˉ1.
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
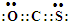 .
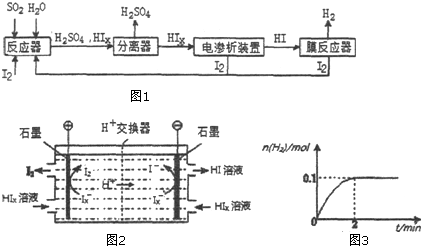
.

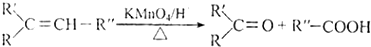
 .
. .
.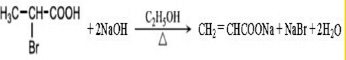 .
. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).