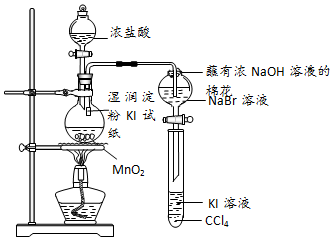
题目内容
10.标准状况下,CO2分子数为6.02×1022,氧原子的物质的量为3.2g,CO2的体积为2.24L.分析 根据n=$\frac{N}{{N}_{A}}$计算二氧化碳物质的量,根据m=nM计算二氧化碳的质量,根据V=nVm计算二氧化碳的体积,氧原子物质的量为二氧化碳的2倍.
解答 解:6.02×1022个CO2分子的物质的量为$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.1mol,含有氧原子的物质的量为0.1mol×2=0.2mol,
其质量为0.2mol×16g/mol=3.2g,
标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:3.2g;2.24L.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
1.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.根据如表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是IIIA族元素 | |
| C. | 若元素Y处于第3周期,它的单质可与冷水剧烈反应 | |
| D. | 元素X与氯元素形成化合物时,化学式可能是XCl |
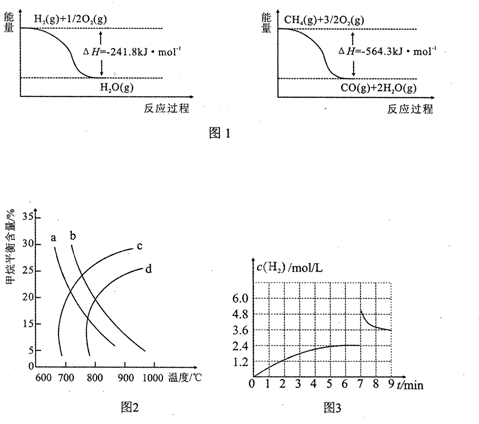
15. 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
a.此平衡体系,升温平衡向右移动.( A.向左、B.向右、C.不)
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
13.下列说法正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| C. | 可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ/mol,2C(s)+O2(g)═2CO(g)△H=b kJ/mol,则a>b |