题目内容
14.Cu2O和CuO组成的混合物中,Cu的质量分数为88%,则混合物中含Cu2O和CuO的物质的量之比( )| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
分析 设出Cu2O、CuO的物质的量,然后根据混合物中含Cu的质量分数为88%列式计算出混合物中含CuO和Cu2O的物质的量之比.
解答 解:设混合物中含CuO和Cu2O的物质的量分别为x、y,
则混合物中铜的质量分数为:$\frac{64(2x+y)}{144x+80y}$×100%=88%,
整理可得:x:y=5:1,则混合物中含Cu2O和CuO的物质的量之比1:5;
故选D.
点评 本题考查了混合物反应的计算,题目难度不大,明确质量分数的概念及表达式即可解答,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.在强酸性溶液中能大量共存的离子组是( )
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |
2.由两种金属组成的混合物12g,与足量的稀H2SO4反应后,在标准状况下产生H2为11.2L,这种金属混合物可能是( )
| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |
9.在NH4CuSO3中加入足量稀硫酸并微热,生成红色固体X、刺激性气味气体Y及蓝色溶液Z,下列说法正确的是( )
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
19.下列说法正确的是 ( )
| A. | 一定温度下,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c(HF)}$始终保持增大 | |
| B. | 浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中:3c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1 | |
| D. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
4.COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是( )
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
5.根据元素周期表和元素周期律,下列推断中错误的是( )
| A. | 砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 | |
| B. | 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 | |
| C. | 镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |

 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O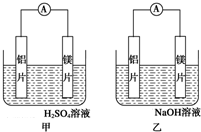 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.