题目内容
5.根据元素周期表和元素周期律,下列推断中错误的是( )| A. | 砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 | |
| B. | 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 | |
| C. | 镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
分析 A.卤素单质从上到下颜色加深、状态由气→液→固变化,非金属性减弱,AgX不溶于水和硝酸(AgF除外);
B.金属和非金属元素的分界线附近的元素作半导体材料;
C.同主族元素化合物性质相似,且具有递变性;
D.同主族从上到下非金属性减弱,对应离子的还原性增强.
解答 解:A.卤素单质从上到下颜色加深、状态由气→液→固变化,非金属性减弱,AgX不溶于水和硝酸(AgF除外),则砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸,故A正确;
B.金属和非金属元素的分界线附近的元素作半导体材料,而在非金属元素区寻找制取新农药的元素,故B错误;
C.由硫酸钡不溶于水,氢氧化钡为强碱可知,镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱,故C正确;
D.同主族从上到下非金属性减弱,对应离子的还原性增强,则溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸,故D正确;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
14.Cu2O和CuO组成的混合物中,Cu的质量分数为88%,则混合物中含Cu2O和CuO的物质的量之比( )
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
17.下列有关叙述正确的是( )
| A. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 | |
| D. | 25℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,Ag2CrO4先析出 |
14.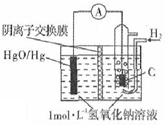 某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )
某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )
 某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )
某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )| A. | 正极反应为:HgO(s)-2e-+H20=Hg(l)+2OH- | |
| B. | 放电结束后,溶液中的pH值下降 | |
| C. | 每反应2.24L氢气,交换膜通过0.2mol离子 | |
| D. | 电子通过离子交换膜从负极向正极移动,保持溶液中电荷平衡 |

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;
 .
. .
. 与过量的
与过量的 也可以发生Reformatsky反应,试写出该生成物的结构简式
也可以发生Reformatsky反应,试写出该生成物的结构简式 .
.