题目内容
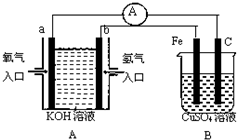 根据如图所示装置回答问题:
根据如图所示装置回答问题:(1)装置A中a电极的电极反应式为
(2)装置B中C为
(3)当铁电极的质量变化为19.2g时,a极上消耗O2在标准状况下的体积为
(4)当装置A中消耗0.05mol氢气时,装置B中溶液的pH为
(5)若将装置B改为电解精炼铜,则粗铜作
考点:原电池和电解池的工作原理
专题:电化学专题
分析:左边装置是原电池,氢氧原料原电池中,投放燃料的电极是负极,负极上失电子发生氧化反应,投放氧化剂的电极是正极,正极上发生还原反应;右边装置是电解池,电解池阳极上失电子发生氧化反应,阴极上得电子发生还原反应,据此分析解答.
解答:
解:(1)装置A中a电极是负极,电极反应式为:H2+2OH--2e-═2H2O,b电极是正极,电极反应为:O2+4e-+2H2O=4OH-,故答案为:H2+2OH--2e-═2H2O;O2+4e-+2H2O=4OH-;
(2)右边装置是电解池,和负极相连Fe电极是阴极,C电极是阳极,在阳极上发生呢个失电子的氧化反应,电极反应为:4OH--4e-=O2↑+2H2O,
故答案为:阳;4OH--4e-=O2↑+2H2O;
(3)当铁电极的质量变化为19.2g时,根据电极反应Cu2++2e-=Cu,转移电子是0.5mol,根据a电极反应:O2+4e-+2H2O=4OH-,所以a极上消耗O2在标准状况下的体积为
0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(4)当装置A中消耗0.05mol氢气时,根据反应H2+2OH--2e-═2H2O,则转移电子是0.1mol,根据B中电解原理方程式::2Cu2++2H2O
2Cu+O2↑+4H+,转移电子是0.1mol,生成氢离子是0.1mol,所以氢离子浓度是1mol/L,pH=0,故答案为:0;
(5)若将装置B改为电解精炼铜,则粗铜作阳极,在阴极上是铜离子得电子的还原反应,即Cu2++2e-=Cu,故答案为:阳;Cu2++2e-=Cu.
(2)右边装置是电解池,和负极相连Fe电极是阴极,C电极是阳极,在阳极上发生呢个失电子的氧化反应,电极反应为:4OH--4e-=O2↑+2H2O,
故答案为:阳;4OH--4e-=O2↑+2H2O;
(3)当铁电极的质量变化为19.2g时,根据电极反应Cu2++2e-=Cu,转移电子是0.5mol,根据a电极反应:O2+4e-+2H2O=4OH-,所以a极上消耗O2在标准状况下的体积为
0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(4)当装置A中消耗0.05mol氢气时,根据反应H2+2OH--2e-═2H2O,则转移电子是0.1mol,根据B中电解原理方程式::2Cu2++2H2O
| ||
(5)若将装置B改为电解精炼铜,则粗铜作阳极,在阴极上是铜离子得电子的还原反应,即Cu2++2e-=Cu,故答案为:阳;Cu2++2e-=Cu.
点评:本题考查了原电池和电解池原理,难度不大,注意氢氧燃料电池中电极反应式的书写,书写时要结合电解质溶液的酸碱性,酸碱性不同,电极反应式的书写不同.

练习册系列答案
相关题目
关于Na2O2的叙述正确的是(NA表示阿伏伽德罗常数)( )
| A、7.8g Na2O2含有的共价键数为0.2NA |
| B、7.8 g Na2S与Na2O2的混合物,含离子总数为0.3 NA |
| C、7.8g Na2O2与足量的CO2充分反应,转移的电数为0.2NA |
| D、0.2 mol Na被完全氧化生成7.8g Na2O2,转移电子的数目为0.4NA |
 如图装置中,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图装置中,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )| A、若a为NO,b为NaOH溶液,可出现无色喷泉 |
| B、若a为HCl,b为AgNO3溶液,可出现白色喷泉 |
| C、若a为CO2,b为NaOH溶液,可出现无色喷泉 |
| D、若a为NH3,b为水(预先滴入少量酚酞溶液),可出现红色喷泉 |
下列与金属腐蚀有关的说法中,不正确的是( )
| A、钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B、电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C、金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D、铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 |
下列物质属于非电解质的一组是( )
| A、盐酸、食盐、水银 |
| B、水玻璃、冰、火碱 |
| C、纯碱、铜绿、漂白粉 |
| D、干冰、液氨、酒精 |
下列不涉及氧化还原反应的是( )
| A、自然界中“氮的固定” |
| B、用铂丝蘸取NaCl溶液进行焰色反应 |
| C、食物腐败变质 |
| D、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体.下列说法不正确的是( )
| A、CN-中碳元素的化合价为+2 |
| B、该反应的产物之一是无毒的N2 |
| C、当1 mol CN-参与反应时,转移3 mol e- |
| D、处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6 L |
元素性质呈现周期性变化的根本原因是( )
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |
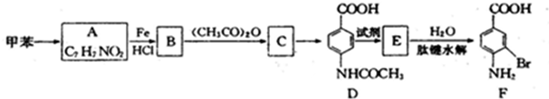
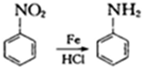
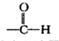 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位