题目内容
硫元素有多种化合价,可形成多种化合物.
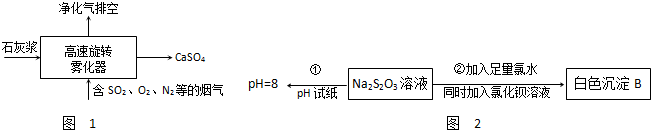
(1)旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如图1所示,写出雾化器中发生反应的化学方程式: .
(2)已知NaHSO3溶液显弱酸性,其原因用离子方程式为: .
(3)请按照浓度由大到小的顺序排列0.1mol/L Na2SO3溶液中的离子 .Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”).
(4)某同学在常温下设计如图2实验流程探究Na2S2O3的化学性质.实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH-)=10-8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3能发生水解,其离子方程式为S2O32-+2H2O═H2S2O3+2OH-,
实验②说明Na2S2O3具有 性.写出发生反应的离子方程式 .

(1)旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如图1所示,写出雾化器中发生反应的化学方程式:
(2)已知NaHSO3溶液显弱酸性,其原因用离子方程式为:
(3)请按照浓度由大到小的顺序排列0.1mol/L Na2SO3溶液中的离子
(4)某同学在常温下设计如图2实验流程探究Na2S2O3的化学性质.实验①可说明
A.该Na2S2O3溶液中水电离的c(OH-)=10-8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3能发生水解,其离子方程式为S2O32-+2H2O═H2S2O3+2OH-,
实验②说明Na2S2O3具有
考点:含硫物质的性质及综合应用,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:基本概念与基本理论,元素及其化合物
分析:(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙;
(2)HSO3-在溶液中部分电离出氢离子;
(3)Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;根据亚硫酸酸根离子的还原性分析;
(4)常温下实验①测定溶液PH=8,说明溶液呈碱性,H2S2O3是一种弱酸,据此分析判断选项;实验②发生反应是利用氯气氧化 硫代硫酸钠为硫酸钠,结合钡离子生成硫酸钡沉淀.
(2)HSO3-在溶液中部分电离出氢离子;
(3)Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;根据亚硫酸酸根离子的还原性分析;
(4)常温下实验①测定溶液PH=8,说明溶液呈碱性,H2S2O3是一种弱酸,据此分析判断选项;实验②发生反应是利用氯气氧化 硫代硫酸钠为硫酸钠,结合钡离子生成硫酸钡沉淀.
解答:
解:(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙,反应的方程式为2SO2+2Ca(OH)2+O2=2CaSO4+2H2O,
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(2)HSO3-在溶液中部分电离出氢离子,所以NaHSO3溶液显弱酸性,其电离的离子方程式为:HSO3-?H++SO32-;
故答案为:HSO3-?H++SO32-;
(3)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);亚硫酸酸根离子具有较强的还原性,能被空气中的氧气氧化为硫酸根离子,硫酸根离子不水解,则溶液的碱性降低,pH减小;
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);减小;
(3)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,
A.该Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,水电离的c(OH-)=10-6mol/L,故A错误;
B.Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,证明H2S2O3是一种弱酸,故B正确;
C.Na2S2O3是钠盐是一种强电解质,故C错误;
D.Na2S2O3水解分步进行,反应的离子方程式为S2O32-+H2O?HS2O3-+OH-,HS2O3-+H2O?H2S2O3+OH-,故D错误;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,说明Na2S2O3具有还原性,硫酸钠结合钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:B;还原性;S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+.
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(2)HSO3-在溶液中部分电离出氢离子,所以NaHSO3溶液显弱酸性,其电离的离子方程式为:HSO3-?H++SO32-;
故答案为:HSO3-?H++SO32-;
(3)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);亚硫酸酸根离子具有较强的还原性,能被空气中的氧气氧化为硫酸根离子,硫酸根离子不水解,则溶液的碱性降低,pH减小;
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);减小;
(3)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,
A.该Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,水电离的c(OH-)=10-6mol/L,故A错误;
B.Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,证明H2S2O3是一种弱酸,故B正确;
C.Na2S2O3是钠盐是一种强电解质,故C错误;
D.Na2S2O3水解分步进行,反应的离子方程式为S2O32-+H2O?HS2O3-+OH-,HS2O3-+H2O?H2S2O3+OH-,故D错误;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,说明Na2S2O3具有还原性,硫酸钠结合钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:B;还原性;S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+.
点评:本题考查了方程式的书写、反应产物定量分析判断,盐类水解应用,离子浓度大小比较方法等,题目综合性较强,难度较大,侧重于考查学生对基础知识的综合应用能力,熟练掌握基础是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、1Llmol/L醋酸溶液中离子总数为2NA |
| B、标准状况下,2.24L的己烷中含有C-H键的数目为0.6NA |
| C、常温常压下,1mol苯含C=C为3NA |
| D、乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子 |
下列各项表达中不正确的是( )
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: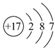 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、6.4g铜粉与足量硫粉充分反应,失去的电子数为0.2NA |
| B、Na2O2与足量H2O反应生成0.2mol O2,转移电子的数目为0.4NA |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| D、0.5mol?L-1 CuCl2溶液中含有Cu2+数小于0.5NA |