题目内容
在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.2mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.2 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.3 mol?L-1 |
| D、Z为0.4 mol?L-1 |
考点:化学平衡的计算
专题:
分析:衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:
解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.1 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.3 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.1<c(Y2)<0.4,0<c(Z)<0.4,
所以Z不可能为0.4 mol/L,故D错误.
故选AB.
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.1 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.3 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.1<c(Y2)<0.4,0<c(Z)<0.4,
所以Z不可能为0.4 mol/L,故D错误.
故选AB.
点评:本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列离子方程式书写正确的是( )
| A、在FeI2溶液中滴入几滴稀溴水:Fe2++Br2=2Fe3++2Br- |
| B、FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2-═2Fe2++S↓ |
| C、在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3-+OH-=SO32-+H2O |
| D、等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.则下列结论正确的是( )
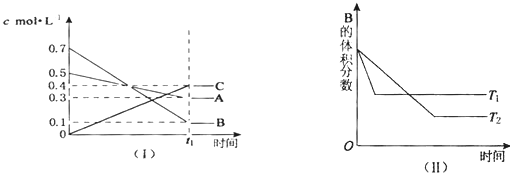

| A、该反应的化学方程式为:2A(g)+7B(g)?4C(g);△H<0 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、在(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率减小 |
化学无处不在,下列与化学有关的说法正确的是( )
| A、蛋白质受热能发生变性,故加热能杀死流感病毒 |
| B、食品添加剂均对人体健康有害,故应禁止使用 |
| C、维生素C因具有酸性,故可做抗氧化剂 |
| D、明矾因有净水作用,故可淡化海水 |
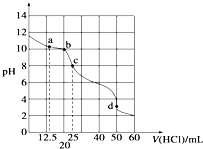 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |

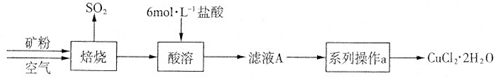

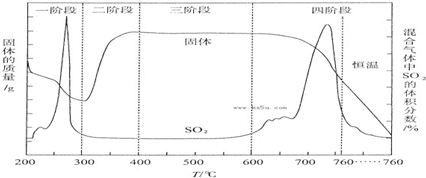
 四种短周期元素A、B、C、D的性质或结构信息如下.
四种短周期元素A、B、C、D的性质或结构信息如下.