题目内容
9.对可逆反应A(g)+2B(g)?3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
分析 A.反应正逆反应速率相同说明反应达到平衡状态;
B.反应前后气体体积不变,改变压强平衡不变,但正逆反应速率同等程度变化;
C.升高温度平衡向吸热反应方向进行;
D.催化剂改变反应速率降低反应的活化能,改变反应历程不改变化学平衡,反应焓变不变;
解答 解:A.对可逆反应A(g)+2B(g)?3C(g),单位时间内消耗amol(A),同时消耗3amolC时,说明正逆反应速率相同,反应处于平衡状态,故A正确;
B.反应A(g)+2B(g)?3C(g),是气体体积不变的反应,增大容器的体积,压强减小化学平衡不移动,反应速率减小,正逆反应速率同等程度减小,故B错误;
C.升高温度使c(B)增大,平衡逆向进行,逆反应是吸热反应,可知正反应为放热反应,故C正确;
D.催化剂改变反应速率降低反应的活化能,改变反应历程不改变化学平衡,反应的△H与起始物质和终了物质有关与变化过程无关,焓变不会变,故D正确;
故选B.
点评 本题考查了影响化学平衡的因素分析,主要是温度、压强、催化剂等影响平衡移动方向的判断,注意确定的化学反应反应焓变不随改变条件变化,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
4.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②生成物产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂.
①生成物的质量分数一定增加 ②生成物产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂.
| A. | ②⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ④⑥ |
14.如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.
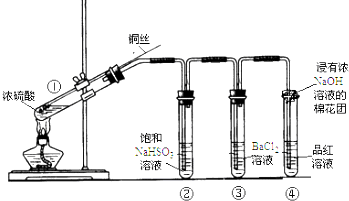
(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式.
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.

(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.
18.4G网络让手机飞起来了.手机芯片的核心是硅板,其成分是( )


| A. | SiO2 | B. | Si | C. | H2Si03 | D. | Na2SiO3 |
2.下列有关说法中,正确的是( )
| A. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| B. | 碳酸钠可作为治疗胃酸过多的药物,食品发酵剂 | |
| C. | 通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体 | |
| D. | 焰色反应一定伴随着化学变化和物理过程 |
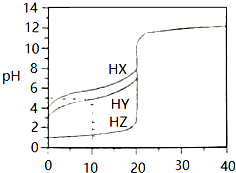 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题: