题目内容
20.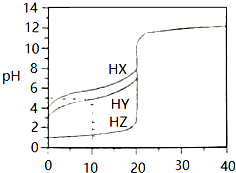 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:(1)判断三种酸的酸性强弱.
(2)写出三种酸与NaOH溶液反应的离子方程式;若三种酸的pH相等,请判断完全中和时相同体积的这三种酸所耗的NaOH溶液的体积大小关系.
分析 (1)未加OH溶液时,相同浓度的这三种酸,酸的pH越大,说明酸的电离程度越小,酸的酸性越弱;
(2)根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质;
若三种酸的pH相同时,酸的电离程度越大其浓度越小,完全中和酸消耗NaOH体积与酸的物质的量成正比.
解答 解:(1)未加OH溶液时,相同浓度的这三种酸,酸的pH越大,说明酸的电离程度越小,酸的酸性越弱,根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质,且HY的电离程度大于HX,所以酸性强弱顺序是HZ>HY>HX,
答:这三种酸的强弱顺序是HZ>HY>HX;
(2)根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质,则这三种酸与NaOH反应离子方程式分别为HX+OH-=X-+H2O、HY+OH-=Y-+H2O、H++OH-=H2O;
若三种酸的pH相同时,酸的电离程度越大其浓度越小,电离程度HX<HY<HZ,所以相同pH的这三种酸浓度大小顺序是c(HX)>c(HY)>c(HZ),完全中和等体积的这三种酸消耗NaOH体积与酸的物质的量成正比,n(HX)>n(HY)>n(HZ),所以消耗V(NaOH)大小顺序是HX>HY>HZ,
答:离子方程式分别为;HX+OH-=X-+H2O、HY+OH-=Y-+H2O、H++OH-=H2O;消耗V(NaOH)大小顺序是HX>HY>HZ.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确相同浓度的酸的pH与酸电离程度关系是解本题关键,易错点是pH相同酸的浓度大小判断,题目难度不大.

| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.若将B的溶液酸化,并加入铜片,则能生成一种气体,该气体遇空气变为红棕色
根据上述实验填空:
(1)写出B、D的化学式:BKNO3 DCuSO4
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理铝离子易水解生成氢氧化铝胶体,能吸附水中的悬浮物而净水,Al3++3H2O?Al(OH)3(胶体)+3H+
(5)若向含溶质1mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466克.
| A. | CH3CH2OH | B. | CH3CH2Cl | C. | CH2BrCH2Br | D. | CH2=CHCl |
| A. | 将氯气与通入冷的消石灰中反应制漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| B. | 向较浓的Na2SiO3溶液中滴加适量盐酸制得硅酸胶体:Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 用氢氟酸刻蚀玻璃:SiO2+4HF═SiF4+2H2O |
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
| A. | NO | B. | O2 | C. | NH3 | D. | CO |
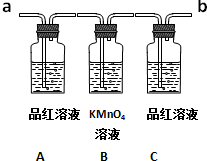 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2