题目内容
19.将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
(1)A点沉淀的总物质的量n=0.1mol.
(2)V2=300mL
(3)若混合物仍为0.1mol,其中Mg的物质的量分数为a,用100mL 3mol/LHCl溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为0.4≤a<1.
分析 镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,故当氢氧化钠体积为V2mL,n(NaOH)=n(HCl),据此解答(1)(2);
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL3mol•L-1盐酸溶解后,再加入360mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=300ml,再加入60mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.1mol,据此判断镁的物质的量范围及a的范围.
解答 解:镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,
(1)根据分析可知,A点的沉淀为:Mg(OH)2、Al(OH)3,镁和流程的物质的量为0.1mol,根据质量守恒定律,则A点生成沉淀的物质的量为0.1mol,
故答案为:0.1mol;
(2)加入V2mLNaOH时,n(NaOH)=n(HCl)=3mol•L-1×0.1L=0.3mol,V(NaOH)=$\frac{0.3mol}{1mol/L}$=0.3L=300mL,
故答案为:300mL;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,则镁的物质的量为0.1amol,
用100mL 3mol/LHCl溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:V2=300mL,再加入60mL 1mol•L-1氢氧化钠溶液,
所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.1mol,则0.04mol≤n(Mg)<0.1mol,
则a的范围为:0.4≤a<1,
故答案为:0.4≤a<1.
点评 本题以图象题的形式考查镁铝单质及其化合物性质、混合物反应的计算,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意掌握常见金属及其化合物性质,明确混合物计算的常用方法.

| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| C. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 | |
| D. | “血液透析”原理与胶体的性质无关 |
| A. | 具有吸附性 | |
| B. | 溶解度大于CuS、PbS、CdS | |
| C. | 溶解度小于CuS、PbS、CdS | |
| D. | MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子 |
| A. | 0.5L | B. | 5L | C. | 11.2L | D. | 不能确定 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.若将B的溶液酸化,并加入铜片,则能生成一种气体,该气体遇空气变为红棕色
根据上述实验填空:
(1)写出B、D的化学式:BKNO3 DCuSO4
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理铝离子易水解生成氢氧化铝胶体,能吸附水中的悬浮物而净水,Al3++3H2O?Al(OH)3(胶体)+3H+
(5)若向含溶质1mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466克.
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
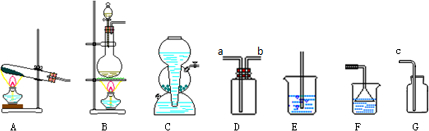
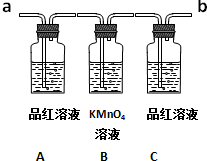 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2