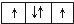
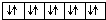
题目内容
20.根据元素周期表1-18号元素的性质和递变规律,回答下列问题(按要求作答)(1)金属性最强的元素与非金属性最强的元素形成的化合物电子式为
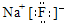 .
.(2)最高价氧化物对应水化物酸性最强的化学式HClO4(填化学式.)
(3)单质既能与HCl反应,又能与NaOH反应的元素是Al(填元素符号).
(4)推测Si、N最简单氰化物的稳定性最稳定的是NH3.(填化学式)
分析 (1)元素周期表1-18号元素中,金属性最强的为Na,非金属性最强的为F,二者形成离子化合物NaF;
(2)元素的非金属性越强,对应的最高价氧化物对应的水化物酸性越强;
(3)能够与盐酸和氢氧化钠溶液反应的单质为Al;
(4)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定.
解答 解:(1)金属性最强的元素为Na,非金属性最强的元素为F,二者形成的化合物为NaF,氟化钠是离子化合物,由氟离子与钠离子构成,电子式为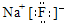 ,
,
故答案为: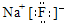 ;
;
(2)Cl的非金属性仅次于O、F,但O、F无正价,最高价氧化物对应的水化物HClO4酸性最强,
故答案为:HClO4;
(3)单质既能与HCl反应,又能与NaOH反应的元素为金属Al,
故答案为:Al;
(4)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,所以稳定性氨气>甲烷,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定,所以稳定性硅烷<甲烷,所以稳定性较强的为NH3,
故答案为:NH3.
点评 本题考查元素周期表的结构及应用,题目难度中等,侧重元素在周期表的位置及元素周期律的考查,把握原子半径的比较规律及非金属性的比较方法为解答的关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |
11.下列有关元素周期表说法正确的是( )
| A. | 第 IA族元素都是碱金属元素 | |
| B. | 元素原子的最外层电子数等于它的族序数 | |
| C. | 最外层电子数相同的元素不一定在同一个族 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
12.将10molA和5molB放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2min内,消耗A 3.6mol,则在2min时,C的平均速率是( )
| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
10.相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷.此氯代烷0.5mol可与3mol氯气发生完全取代反应,则该烃的结构简式为( )
| A. | CH3CH3 | B. | CH2═CH2 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
 氯化苄是一种无色或微黄色的透明液体,是一种重要的化工、医药中间体.它的结构如图所示,则氯化苄完全氢化后所得到的有机物质在核磁共振氢谱图中有多少个吸收峰( )
氯化苄是一种无色或微黄色的透明液体,是一种重要的化工、医药中间体.它的结构如图所示,则氯化苄完全氢化后所得到的有机物质在核磁共振氢谱图中有多少个吸收峰( )