题目内容
常温下,0.1 mol?L-1CH3COONa溶液pH=a,则下列说法正确的是( )
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
考点:盐类水解的原理
专题:
分析:A、醋酸平衡常数Ka需要水解平衡常数计算;
B、醋酸钠溶液中醋酸根离子水解显碱性,溶液中水电离出的氢氧根离子浓度为电离的水的浓度;
C、加热促进水解,碱性增强;
D、加水稀释促进电离,离子浓度减小,氢氧根离子浓度减小.
B、醋酸钠溶液中醋酸根离子水解显碱性,溶液中水电离出的氢氧根离子浓度为电离的水的浓度;
C、加热促进水解,碱性增强;
D、加水稀释促进电离,离子浓度减小,氢氧根离子浓度减小.
解答:
解:A、醋酸平衡常数Ka需要水解平衡常数计算,Kh=
=
×
=
,Ka=
=
,故A错误;
B、醋酸钠溶液中醋酸根离子水解显碱性,溶液中水电离出的氢氧根离子浓度为电离的水的浓度,约有
=1.0×l0a-14 mol?L-1的水发生电离,故B正确;
C、加热促进水解,碱性增强,溶液PH增大,pH>a,故C错误;
D、加水稀释促进电离,离子浓度减小,氢氧根离子浓度减小,PH减小,PH<a,故D错误;
故选B.
| c(CH3COOH)c(OH-) |
| c(CH3COO-) |
| c(CH3COOH)c(OH-) |
| c(CH3COO-) |
| c(H+) |
| c(H+) |
| Kw |
| Ka |
| Kw |
| Kh |
| 10-14 | ||
|
B、醋酸钠溶液中醋酸根离子水解显碱性,溶液中水电离出的氢氧根离子浓度为电离的水的浓度,约有
| 10-14 |
| 10-a |
C、加热促进水解,碱性增强,溶液PH增大,pH>a,故C错误;
D、加水稀释促进电离,离子浓度减小,氢氧根离子浓度减小,PH减小,PH<a,故D错误;
故选B.
点评:本题考查了盐类水解的分析判断,弱电解质电离平衡常数的计算应用和影响水解平衡的因素分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
A、电解氯化镁溶液:2Cl-+2H2O
| ||||
| B、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO | ||||
| C、将少量CO2气体通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | ||||
| D、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O |
对H2O的电离平衡不产生影响的微粒是( )
A、 |
B、 |
C、 |
D、 |
用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
A、 用装置制取少量H2: |
B、 用装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
C、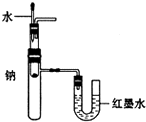 用装置验证Na和水反应的热效应 |
D、 用装置蒸干A1Cl3溶液制备无水AlC13 |

 +R′-Cl→
+R′-Cl→ +HCl
+HCl



 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). (1)已知下列反应:
(1)已知下列反应: