题目内容
研究NO2、SO2等大气污染气体的处理具有重要意义.
(1)铜与浓硝酸反应生成NO2的化学反应方程式是 .
(2)NO2可用水吸收,该反应的化学反应方程式是 .
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式 .
(4)利用反应6NO2+8NH3
7N2+12H2O也可处理NO2.当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L.
(5)已知:2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H= kJ?mol-1.
一定条件下,将NO2与SO2以物质的量之比1:2置于恒容密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是 .
A.体系压强保持不变
B.SO3和NO的体积比保持不变
C.混合气体颜色保持不变
D.每消耗1mol SO3的同时消耗1mol NO2
②测得上述反应平衡时NO2与SO2物质的量之比为1:11,该反应的平衡常数
K= (保留1位小数).
(1)铜与浓硝酸反应生成NO2的化学反应方程式是
(2)NO2可用水吸收,该反应的化学反应方程式是
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式
(4)利用反应6NO2+8NH3
| 催化剂 |
| 加热 |
(5)已知:2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
一定条件下,将NO2与SO2以物质的量之比1:2置于恒容密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.SO3和NO的体积比保持不变
C.混合气体颜色保持不变
D.每消耗1mol SO3的同时消耗1mol NO2
②测得上述反应平衡时NO2与SO2物质的量之比为1:11,该反应的平衡常数
K=
考点:氮的氧化物的性质及其对环境的影响,用盖斯定律进行有关反应热的计算,化学平衡状态的判断
专题:化学反应中的能量变化,化学平衡专题,氮族元素
分析:(1)铜与浓硝酸发生反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)NO2可用水吸收,生成硝酸和一氧化氮;
(3)二氧化硫与铁离子发生氧化还原反应,根据得失电子守恒;
(4)反应6NO2+8NH3
7N2+12H2O方程式可知8NH3~~24mole-,分析解答;
(5)根据盖斯定律来分析计算:一个反应无论是一步完成还是分为几步完成,其热效应是相同的;
①根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
②根据三行式以及化学平衡常数表达式计算化学平衡常数.
(2)NO2可用水吸收,生成硝酸和一氧化氮;
(3)二氧化硫与铁离子发生氧化还原反应,根据得失电子守恒;
(4)反应6NO2+8NH3
| 催化剂 |
| 加热 |
(5)根据盖斯定律来分析计算:一个反应无论是一步完成还是分为几步完成,其热效应是相同的;
①根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
②根据三行式以及化学平衡常数表达式计算化学平衡常数.
解答:
解:(1)铜与浓硝酸发生反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO;
(3)二氧化硫与铁离子发生氧化还原反应,方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)反应6NO2+8NH3
7N2+12H2O方程式可知8NH3~~24mole-,所以消耗的NH3在标准状况下的体积是
×8×22.4=4.48L,故答案为:4.48;
(5)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ?mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ?mol-1.
根据盖斯定律可知:将
-
可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=
-
=-41.8 kJ?mol-1
故答案为:-41.8;
①该反应为反应前后气体分子数不变的反应,因此压强保持不变,不能作为达到平衡的标志;
A、反应为反应前后气体分子数不变的反应,因此压强保持不变,不能作为达到平衡的标志,故A不符合;
B、SO3和NO的体积之比保持不变,在反应过程中始终是1:1,不能说明反应达到平衡,故B不符合;
C、反应平衡中二氧化氮是红棕色气体,颜色变化说明你的改变,所以混合气体的颜色保持不变可以做达到平衡的标志,故C符合;
D、每消耗1mol SO3的同时生成1mol NO2,正逆反应速率相等,证明反应达到平衡,故D符合;
故选CD.
②一定条件下,将NO2与SO2以体积之比1:2置于密闭容器中发生上述反应,设为a和 2a,测得上述反应达到平衡状态时NO2与SO2的体积之比为1:11,设二氧化氮反应的物质的量为x
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
则(a-x):(2a-x)=1:11,故x=
a,故平衡常数为=
=
=7.4;
故答案为:7.4.
(2)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO;
(3)二氧化硫与铁离子发生氧化还原反应,方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)反应6NO2+8NH3
| 催化剂 |
| 加热 |
| 0.6 |
| 24 |
(5)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ?mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ?mol-1.
根据盖斯定律可知:将
| ① |
| 2 |
| ② |
| 2 |
| -196.6 |
| 2 |
| -113.0 |
| 2 |
故答案为:-41.8;
①该反应为反应前后气体分子数不变的反应,因此压强保持不变,不能作为达到平衡的标志;
A、反应为反应前后气体分子数不变的反应,因此压强保持不变,不能作为达到平衡的标志,故A不符合;
B、SO3和NO的体积之比保持不变,在反应过程中始终是1:1,不能说明反应达到平衡,故B不符合;
C、反应平衡中二氧化氮是红棕色气体,颜色变化说明你的改变,所以混合气体的颜色保持不变可以做达到平衡的标志,故C符合;
D、每消耗1mol SO3的同时生成1mol NO2,正逆反应速率相等,证明反应达到平衡,故D符合;
故选CD.
②一定条件下,将NO2与SO2以体积之比1:2置于密闭容器中发生上述反应,设为a和 2a,测得上述反应达到平衡状态时NO2与SO2的体积之比为1:11,设二氧化氮反应的物质的量为x
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
则(a-x):(2a-x)=1:11,故x=
| 9 |
| 10 |
| c(NO)c(SO3) |
| c(NO2)c(SO2) |
| x2 |
| (a-x)(2a-x) |
故答案为:7.4.
点评:本题考查热化学方程式书写方法和盖斯定律的应用,平衡判断依据的分析,化学平衡计算方法的应用,题目难度中等.

练习册系列答案
相关题目
 短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如图所示,其中只有Z为金属元素.则下列说法中,正确的是( )
短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如图所示,其中只有Z为金属元素.则下列说法中,正确的是( )| A、W、X两种元素在自然界中都存在相应的单质 |
| B、Q、Y分别与活泼金属元素形成的化合物中仅含离子键 |
| C、Y、Z分别形成的简单离子中,前者的半径较大 |
| D、X、Z的最高价氧化物对应的水化物之间容易相互发生反应 |
常温下,0.1 mol?L-1CH3COONa溶液pH=a,则下列说法正确的是( )
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
下列有实验装置的说法,正确的是( )
A、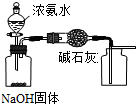 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
 以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.
以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.

