题目内容
对H2O的电离平衡不产生影响的微粒是( )
A、 |
B、 |
C、 |
D、 |
考点:水的电离
专题:
分析:水的电离方程式为H2O═H++OH-,加入酸或碱能抑制水的电离,加入含有弱根离子的盐能促进水的电离,否则不影响水的电离,据此分析解答
解答:
解:A.氯化氢溶于水后能电离出氢离子,使水的电离向左移动,所以能抑制水的电离,故A错误;
B.26M3+为Fe3+,Fe3+能结合水电离的氢氧根离子生成弱电解质,使水的电离向正移,所以促进水的电离,故B错误;
C. 为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C正确;
为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C正确;
D.加入了CH3COO-,CH3COO- 会结合H+,c(H+)减小,使水的电离平衡向右移动,促进水的电离,故D错误;
故选C.
B.26M3+为Fe3+,Fe3+能结合水电离的氢氧根离子生成弱电解质,使水的电离向正移,所以促进水的电离,故B错误;
C.
 为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C正确;
为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C正确;D.加入了CH3COO-,CH3COO- 会结合H+,c(H+)减小,使水的电离平衡向右移动,促进水的电离,故D错误;
故选C.
点评:本题考查了水的电离,影响水的电离的因素有:温度、酸碱、含有弱根离子的盐,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离.

练习册系列答案
相关题目
设nA为阿伏加德罗常数,下列说法正确的是( )
| A、常温下,28g C2H4含nA个碳碳双键 |
| B、1 mol Cu和足量稀硝酸反应生成nA NO分子 |
| C、常温常压下,22.4L CCl4含有nA个CCl4分子 |
| D、1mol/L NaCl溶液含有nA个Na+ |
四种短周期元素在周期表中的相对位置如图所示,其中Y为空气中含量最大的元素.下列叙述合理的是( )
| X | Y | |
| Z | W |
| A、元素W位于第三周期第ⅦA族 |
| B、Y、Z都是植物必需的元素 |
| C、原子半径:W>Z>Y>X |
| D、X氧化物的大量排放导致化学烟雾 |
 某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )
某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )| A、4种 | B、5种 | C、6种 | D、7种 |
常温下,0.1 mol?L-1CH3COONa溶液pH=a,则下列说法正确的是( )
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
下列有实验装置的说法,正确的是( )
A、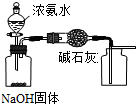 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |


 ,除生成
,除生成 外,另一种产物是
外,另一种产物是