题目内容
9.在反应X+2Y=R+2M中,当32gY与X恰好完全反应后,生成18gM,且生成的R和M的质量比为11:9,则在此反应中,参加反应的X与生成的R的质量比为( )| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
分析 由反应中R和M的质量比为11:9,由生成M的质量计算出物质R的质量;再利用质量守恒定律,计算出参加反应X的质量,从而求得参加反应的X与生成的R的质量比.
解答 解:由32gY与X恰好完全反应后,生成18gM,且生成的R和M的质量比为11:9,反应生成R的质量=$\frac{11}{9}$×18g=22g,
根据质量守恒定律,参加反应的X的质量=18g+22g-32g=8g;
则在此反应中,参加反应的X与生成的R的质量比=8g:22g=4:11.
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,注意掌握质量守恒定律的内容及应用方法,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列物质中属于酸性氧化物的是( )
| A. | NO2 | B. | SO2 | C. | Al2O3 | D. | Fe2O3 |
11.实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液.
(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、Ca(OH)2、NaOH和稀盐酸,其中有颜色的是KMnO4和CuSO4 溶液.
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸.
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液是Na2CO3、NaCl、Ca(OH)2和稀盐酸.
(3)实验探究:同学们按以下步骤进行鉴别.
【第一步】取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
实验结论:C是Na2CO3溶液.
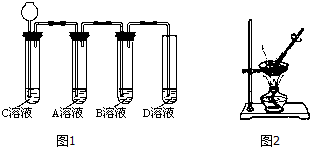
【第二步】依据图1装置进行实验,其中夹持固定装置已略去.从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.
实验解释:A溶液中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
【第三步】依据图2装置进行2个实验.取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.
实验结论:B是稀盐酸,D是NaCl溶液.
经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程.进行了全面反思.
友情提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液.用C溶液简便地鉴别出A、B溶液的方法是:取少量C分别滴入盛有A和B的试管中,A中有白色沉淀产生,A是Ca(OH)2溶液,B中有气泡产生,则可鉴别出B.
(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、Ca(OH)2、NaOH和稀盐酸,其中有颜色的是KMnO4和CuSO4 溶液.
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸.
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液是Na2CO3、NaCl、Ca(OH)2和稀盐酸.
(3)实验探究:同学们按以下步骤进行鉴别.
【第一步】取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
【第二步】依据图1装置进行实验,其中夹持固定装置已略去.从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.

实验解释:A溶液中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
【第三步】依据图2装置进行2个实验.取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.
实验结论:B是稀盐酸,D是NaCl溶液.
经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程.进行了全面反思.
友情提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液.用C溶液简便地鉴别出A、B溶液的方法是:取少量C分别滴入盛有A和B的试管中,A中有白色沉淀产生,A是Ca(OH)2溶液,B中有气泡产生,则可鉴别出B.
8. 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
1. 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号).
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
19.常温下取pH均等于1的硫酸和醋酸各10ml,分别稀释10倍后,再分别加入0.07g锌粉充分反应,有关叙述正确的是( )
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
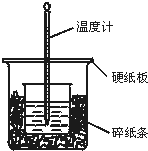 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: .
.