题目内容
10.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,26gC2H2和C6H6的混合物所含原子数为4NA | |
| B. | 标准状况下,11.2LH2O中所含O-H键数目为NA | |
| C. | 1molCl2与足量Fe在点燃条件下发生反应,转移电子数为3NA | |
| D. | 常温下,pH=13的NaOH溶液,OH-离子的数目为0.1NA |
分析 A、C2H2和C6H6的最简式均为CH;
B、标况下水为液态;
C、氯气和铁反应后变为-1价;
D、溶液体积不明确.
解答 解:A、C2H2和C6H6的最简式均为CH,故26g混合物中含有的CH的物质的量为2mol,则含有4NA个原子,故A正确;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的O-H键个数,故B错误;
C、氯气和铁反应后变为-1价,故1mol氯气反应后转移2NA个电子,故C错误;
D、溶液体积不明确,故溶液中含有的氢氧根的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数是电子层数的2倍.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A. | W 的最高价氧化物的水化物酸性比Z的强 | |
| B. | 原子半径:Z>W,离子半径:Z<W | |
| C. | Y的气态氢化物可与W的气态氢化物反应生成一种离子化合物 | |
| D. | X元素形成的化合物种类最多 |
1.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
18.下列各组离子在碱性溶液中能够大量共存的是( )
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
5.下列说法不正确的是( )
| A. | 推广使用氢能、太阳能,减少化石燃料的使用,有助于减少雾霾天气的发生 | |
| B. | 将太阳能转化为氢能是减少污染、缓解能源危机的一种构想 | |
| C. | 石油的分馏、催化裂化、裂解等石油的加工方法,其目的均为得到更多的汽油 | |
| D. | 煤干馏可以得到煤焦油,煤焦油进一步分离又可得到苯、甲苯等有机物 |
11.已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用下图装置进行中和热的测定,请回答下列问题:
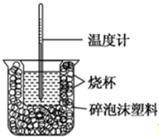
(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
①比较△H1和△H2的相对大小:△H1<△H2(填“>”“<”或“=”).
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.

(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.
8.如图装置放置一段时间后,铁钉均被腐蚀.下列有关描述错误的是( )
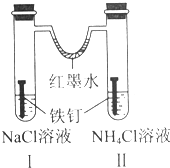

| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
9.下列离子方程式书写正确的是( )
| A. | 氢氧化钡溶液滴入硫酸中:Ba2++SO42-→BaSO4↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+→Cu2++Ag | |
| C. | 醋酸加入氢氧化钠溶液中:H++OH-→H2O | |
| D. | 氯化铁溶液中滴入氢氧化钾溶液:Fe3++3OH-→Fe(OH)3↓ |