题目内容
10.用含有少量银和锌的粗铜做阳极,纯铜作阴极,硫酸侗溶液作电解液,通电一段时间后,阳极质量减轻了6.4g,下列说法正确的是( )| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
分析 用含少量银和锌的粗铜做阳极,电极反应为:Cu-2e-=Cu2+,Zn-2e-=Zn2+,纯铜片做阴极,Cu2++2e-=Cu,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了6.4g,依据电子守恒分析,同质量铜和锌相比,锌物质的量小于铜,电子转移减小,阴极增加小于6.4g.
解答 解:电解精炼中,粗铜作阳极,纯铜作阴极,阳极上铜、锌失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,Zn-2e-=Zn2+,纯铜片做阴极,Cu2++2e-=Cu,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了6.4g,依据电子守恒分析,同质量铜和锌相比,锌物质的量小于铜,和铜相比,电子转移减小,阴极增加小于6.4g,阴极质量增加小于6.4g;
故选C.
点评 本题考查了电解原理的分析应用,主要是电解精炼原理的理解,电极反应电子守恒的分析判断是解题关键,题目难度中等.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
5.常温下,浓度均为0.1mol•L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别缴入NaOH固体,lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
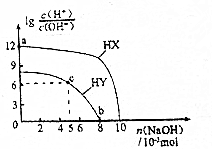

| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
15.在一定条件下的密闭容器中投入4mol A和n mol的B,发生如下反应4A+5B?4C+6D.达到平衡时,测得A的转化率大于B的转化率,则n的取值范围正确的是( )
| A. | n=5 | B. | n<5 | C. | n>5 | D. | 无法判断 |
2.在密闭容器中进行X2(g)+Y2(g)?2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
13.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式: .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为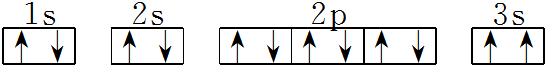 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.