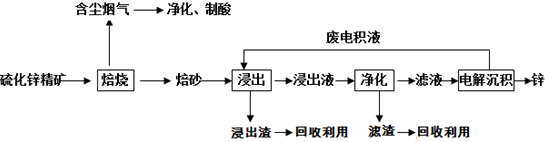
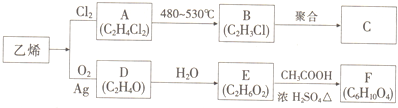
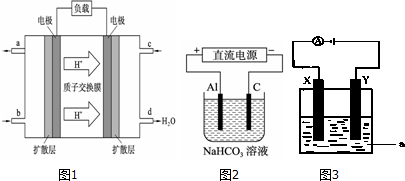
题目内容
15.在一定条件下的密闭容器中投入4mol A和n mol的B,发生如下反应4A+5B?4C+6D.达到平衡时,测得A的转化率大于B的转化率,则n的取值范围正确的是( )| A. | n=5 | B. | n<5 | C. | n>5 | D. | 无法判断 |
分析 先假设n=5,则A、B的转化率相等,然后结合增加可逆反应的一种反应物浓度,该反应物转化率降低,另一种反应物转化率增大判断n的范围.
解答 解:假设n=5,则A、B转化率相等,根据增加可逆反应的一种反应物浓度,该反应物转化率降低,另一种反应物转化率增大可知,若A的转化率大于B的转化率,则B的物质的量n>5,
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意增加可逆反应的一种反应物浓度,该反应物转化率降低,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
5.下列反应属于氧化还原反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O | D. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
10.用含有少量银和锌的粗铜做阳极,纯铜作阴极,硫酸侗溶液作电解液,通电一段时间后,阳极质量减轻了6.4g,下列说法正确的是( )
| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LHCl和11.2LNH3充分混合后含有的分子数为NA | |
| B. | 0.1mol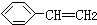 中含有碳碳双键的数目为0.4NA 中含有碳碳双键的数目为0.4NA | |
| C. | 常温常压下,1molNO2与水反应后,溶液中NO3-的数目为NA | |
| D. | 1molMg与足量空气反应生成MgO和Mg3N2,失去的电子数为2NA |
7.乙烷与乙炔相比较,下列叙述不正确的是( )
| A. | 都能燃烧,生成二氧化碳和水 | |
| B. | 乙炔易发生加成反应,乙烷不能发生加成反应 | |
| C. | 都能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色 | |
| D. | 相同物质的量的乙烷和乙炔,完全燃烧时生成CO2量相同 |