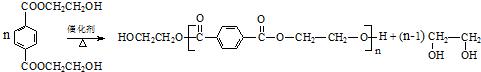
题目内容
1.我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.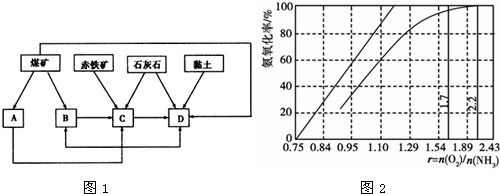
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定图1中相应工厂的名称:
A.发电厂,B.焦化厂,C.炼铁厂,D.水泥厂;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
(2)玻璃钢可由酚醛树脂和玻璃纤维制成.
①酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜间歇性地加入甲醛,且反应釜应装有散热装置.
②玻璃钢中玻璃纤维的作用是增强体.玻璃钢具有强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等优异性能(写出两点即可).
③下列处理废旧热固性酚醛塑料的做法合理的是bc.
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
(3)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
分析 (1)①煤炭燃烧可以发电,煤的干馏制造煤焦油,赤铁矿、碳酸钙是炼铁的原料,碳酸钙和黏土是生产水泥的原料;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①反应物投入的物质的量越多放出的热越多;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等;
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能;
(3)根据氨氧化的化学方程式来分析;根据O2浓度太少不利于NH3的转化分析.
解答 解:(1)①煤炭燃烧可以发电,A为发电厂,煤的干馏制造煤焦油,B为焦化厂,赤铁矿、碳酸钙是炼铁的原料,C为炼铁厂,碳酸钙和黏土是生产水泥的原料,D为水泥厂,
故答案为:发电厂;焦化厂;炼铁厂;水泥厂;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,产生炉渣的方程式为CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①苯酚和甲醛发生缩聚反应,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中间歇性的加入甲醛,并装有散热装置,
故答案为:间歇性;散热;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等,
故答案为:增强体;强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好;
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能,塑料深埋很久不会腐烂,会造成白色污染,酚醛塑料不能溶于有机溶剂,
故选bc;
(3)由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上r{n(O2)/n(NH3)}=$\frac{5}{4}$=1.25,O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,
故答案为:1.25;O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
点评 本题考查金属冶炼,涉及到氧化还原方程式的书写,题目难度中等,本题注意从题目中获取信息,结合物质的性质解答.

| A. |  向容量瓶中转移溶液 | B. |  稀释浓硫酸 | ||
| C. |  制取氨气 | D. |  称取NaOH |
| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、Cl-、Rb+ |
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
| A. | N | B. | P | C. | Se | D. | Te |
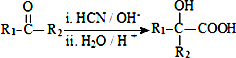 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)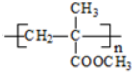 .
.