题目内容
10.已知:298K时,2SO2(g)+O2(g)?2SO3(g);△H=-Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )| A. | 无法比较 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |
分析 2SO2(g)+O2(g)?2SO3(g) 在上述条件下2mol SO2和1molO2完全反应生成2molSO3气体放出热量为Q1kJ,再结合可逆反应中反应物不能完全反应,据此解答.
解答 解:一定温度时:2SO2(g)+O2(g)?2SO3(g);在上述条件下2mol SO2和1molO2,完全反应生成2molSO3气体放出热量为Q1kJ,可逆反应中反应物不能完全反应,故向密闭容器中通入2molSO2和1molO2,参加反应是二氧化硫的物质的量小于2mol,故平衡时放出的热量小于Q1kJ,
所以Q<197 kJ
故选B.
点评 本题考查可逆反应特点、热化学方程式等,为高频考点,侧重于学生的分析能力的考查,难度不大,理解热化学方程式表示的含义是解题关键.

练习册系列答案
相关题目
1.碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途.
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①实验Ⅰ中,前5min的反应速率v(CO2)=0.15mol•L-1•min-1.
②900℃时该反应的平衡常数K=$\frac{1}{3}$
③下列能判断实验Ⅱ已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
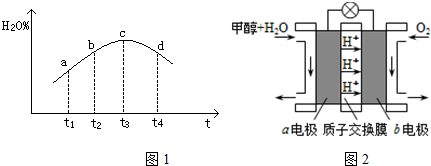
④若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,则b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时正极的电极反应式O2+4e-+4H+=2H2O,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
②900℃时该反应的平衡常数K=$\frac{1}{3}$
③下列能判断实验Ⅱ已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
④若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,则b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.

(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时正极的电极反应式O2+4e-+4H+=2H2O,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
18.下列化学用语正确的是( )
| A. | Cl-的结构示意图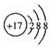 | |
| B. | S2-的结构示意图: | |
| C. | 纯碱的化学式:NaHCO3 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
5.在20℃时一刚性容器内部有一不漏气且可滑动的活塞将容器分隔成左、右室两室.左室充入N2,右室充入H2和O2,活塞正好停留离左端$\frac{1}{5}$处(如图a)然后点燃引爆H2和O2混合器,活塞先左弹(设容器不漏气),恢复至原来温度,活塞恰好停在中间(如图b),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是( )

| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 7:1 |
19.某无土栽培营养液铭牌如表所示:.若要求KCl、K2SO4 和NH4Cl 三种固体原料的物质的量之比为1:4:8,写出详细的计算过程求出a 和b 的数值分别为( )
| 营养液所含成分 | 质量(g) |
| KCl | a |
| K2SO | b |
| NH4Cl | 428 |
| A. | 53.5 和214 | B. | 74.5 和348 | C. | 74.5 和696 | D. | 149 和696 |