题目内容
10.某一定量的铁与稀盐酸反应,标准状况下生成了4.48L氢气,若所用盐酸的浓度为0.5mol/L,则至少需要盐酸的体积为多少升?消耗铁的质量为多少克?分析 溶液中发生反应为Fe+2H+=Fe2++H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,利用离子方程式计算生成的Fe的物质的量;和盐酸的物质的量,由此分析解答.
解答 解:标准状况下4.48L氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,则:
Fe+2H+=Fe2++H2↑,
1mol 2mol 1mol
n(Fe) n(HCl) 0.2mol
所以$\frac{1}{n(Fe)}=\frac{2}{n(HCl)}=\frac{1}{0.2mol}$,
解之得:n(Fe)=0.2mol,n(HCl)=0.4mol,
则:则至少需要盐酸的体积为$\frac{0.4mol}{0.5mol/L}$=0.8L,消耗铁的质量为0.2×56=11.2g,答:需要盐酸的体积为0.8L,消耗铁的质量为11.2g.
点评 本题考查根据方程式的有关计算,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
1.下列有关化学平衡移动叙述中正确的是( )
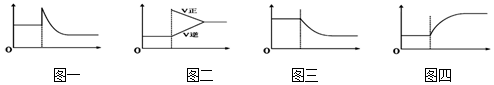

| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
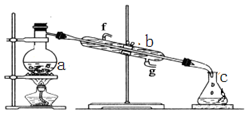
18.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置图1中A的名称是蒸馏烧瓶.A 中一般要加入碎瓷片,其作用是防暴沸.下列关于以上实验操作说法一定正确的是D
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险.
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出.
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度.
D.图4实验中,当加热至有较多固体析出时,即停止加热.
(2)现有一瓶A和B的混合液,已知它们的性质如表.
据此分析,将A和B相互分离可选用图中的图1所示仪器.

(1)装置图1中A的名称是蒸馏烧瓶.A 中一般要加入碎瓷片,其作用是防暴沸.下列关于以上实验操作说法一定正确的是D
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险.
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出.
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度.
D.图4实验中,当加热至有较多固体析出时,即停止加热.
(2)现有一瓶A和B的混合液,已知它们的性质如表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
5.邻甲基苯甲酸(  )有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )
)有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )
 )有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )
)有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
15.下列物质属于电解质的是( )
| A. | 石墨 | B. | 烧碱溶液 | C. | 铜 | D. | 氯化钠晶体 |
2.下列各组物质中互为同位素的是( )
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |
19.下列说法中错误的是( )
| A. | HCl、HBr、HI、HF的沸点依次升高 | |
| B. | 氨分子中N-H键的极性小于水分子中O-H键的极性 | |
| C. | 乙醇分子间存在氢键,乙醛分子间不存在氢键,故乙醇的沸点高于乙醛 | |
| D. | 由于N-H键强于P-H键,故NH3的沸点高于PH3 |
10.已知:298K时,2SO2(g)+O2(g)?2SO3(g);△H=-Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )
| A. | 无法比较 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |