题目内容
20.已知:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O现将9.6g铜完全溶于200ml的硫酸中,试计算:
①标况下产生SO2的体积为3.36L;
②所生成的硫酸铜溶液的物质的量浓度(设反应后溶液的体积为200mL)为0.75mol/L.
分析 ①根据n=$\frac{m}{M}$计算出9.6g铜的物质的量,然后根据反应方程式计算出生成二氧化硫的物质的量,最后根据V=nVm计算出标况下产生SO2的体积;
②根据反应计算出生成硫酸铜的物质的量,然后根据c=$\frac{n}{V}$计算出所生成的硫酸铜溶液的物质的量浓度.
解答 解:①9.6gCu的物质的量为:$\frac{9.6g}{64g/mol}$=0.15mol,根据反应可知,0.15mol铜完全反应生成二氧化硫的物质的量为0.15mol,标况下产生SO2的体积为:22.4L/mol×0.15mol=3.36L,
故答案为:3.36L;
②0.15molCu完全反应生成硫酸铜的物质的量为0.15mol,所生成的硫酸铜溶液的物质的量浓度为:c(CuSO4)=$\frac{0.15mol}{0.2L}$=0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量与气体摩尔体积、物质的量浓度之间的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
10.已知:298K时,2SO2(g)+O2(g)?2SO3(g);△H=-Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )
| A. | 无法比较 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |
15.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质质量如表,则该密闭容器中发生的化学反应类型为分解反应.
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 5 | 5 | 55 | 5 |
| 反应后质量/g | 27 | 待测 | 0 | 19 |
9.阅读、分析下列两个材料:
材料一、如图
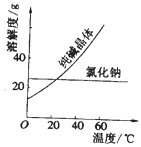
材料二
回答下列问题:
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过蒸发结晶趁热过滤、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是蒸馏法,写出该方法在操作上的注意事项(写出一项)蒸馏烧瓶中应加入沸石.
材料一、如图

材料二
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过蒸发结晶趁热过滤、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是蒸馏法,写出该方法在操作上的注意事项(写出一项)蒸馏烧瓶中应加入沸石.


 .
.