题目内容
2.0.5mol SO2,所含有的分子数为.5NA或3.01×1023个. 等质量的O2和O3所含的原子个数之比是1:1. 标准状况下,2mol NH3与88g CO2的体积相等.分析 根据N=nNA、m=nM计算出0.5mol二氧化硫中含有的分子数、质量;氧气和臭氧中都只有氧原子组成,质量相同的氧气和臭氧中含有相等的原子数;标况下体积相等,则气体的物质的量相等,然后根据m=nM计算出二氧化碳的质量.
解答 解:0.5mol二氧化硫中含有二氧化硫分子的数目为:N=0.5×NA=0.5NA;0.5mol二氧化硫的质量为:m=64g/mol×0.5mol=32g;氧气和臭氧中都只含有氧原子,所以等质量的O2和O3所含的原子个数之比是1:1;标况下,体积相等则气体的物质的量相等,所以二氧化碳的物质的量为2mol,2mol二氧化碳的质量为:44g/mol×2mol=88g,
故答案为:0.5NA或3.01×1023;1:1;88.
点评 本题考查了有关物质的量的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等物理量之间的关系,把握相关计算公式的运用.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
2.下列各组物质中互为同位素的是( )
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |
10.已知:298K时,2SO2(g)+O2(g)?2SO3(g);△H=-Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )
| A. | 无法比较 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |
 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )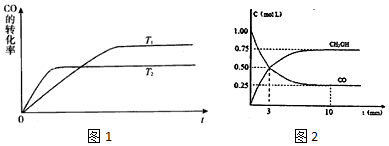
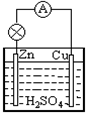 .
.