题目内容
11.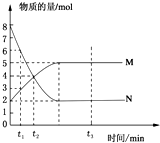 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:(1)写出此反应的化学方程式2N(g)?M(g)
(2)下列叙述中能说明上述反应达到平衡状态的是BCD.
A.反应中M与N的物质的量之比为1:1
B.在混合气体中N的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的压强不随时间的变化而变化
(3)若t3=3,则3min内用M表示的反应速率是0.5mol/(L•min)
(4)在t2时刻正反应速率v(正)与逆反应速率v(逆)的大小关系是v(正)>v(逆).
(5)反应达到平衡后,N所占的体积分数是28.6%(保留一位小数).
分析 (1)根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
(3)根据v=$\frac{△c}{△t}$计算;
(4)t2时刻,根据图象N的物质的量继续减小,M的物质的量增加,反应正向进行;
(5)体积分数之比=物质的量之比,根据图象分析.
解答 解:(1)随时间进行,N的物质的量为定值且不为零,反应为可逆反应,且△n(N):△n(M)=(8-2)mol:(5-2)mol=2:1,则反应的化学方程式为:2N(g)?M(g),
故答案为:2N(g)?M(g);
(2)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,故A错误;
B.当反应达到平衡状态时,各物质的浓度、含量不再改变,混合气体中N的质量百分数保持不变,说明到达平衡,故B正确;
C.随反应进行混合气体总物质的量发生变化,混合气体的平均相对分子不随时间的变化而变化,说明总物质的量不变,说明达平衡,故C正确;
D.随反应进行混合气体总物质的量发生变化,混合气体的压强不随时间的变化而变化即混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故D正确;
故答案为:BCD;
(3)根据v=$\frac{△c}{△t}$,若t3=3,则3min内用M表示的反应速率v=$\frac{\frac{(5-2)mol}{2L}}{3min}$=0.5mol/(L•min),
故答案为:0.5mol/(L•min);
(4)t2时刻,根据图象N的物质的量继续减小,M的物质的量增加,反应正向进行,则v(正)>v(逆),
故答案为:v(正)>v(逆);
(5)体积分数之比=物质的量之比,根据图象分析反应达到平衡后,N所占的体积分数=$\frac{2}{2+5}$=28.6%,
故答案为:28.6%.
点评 本题主要考查化学平衡状态的判断,根据图象计算反应速率等,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NaCl和KNO3 | B. | BaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | KOH和NaNO3 |
| A. | 一种金属元素和一种非金属元素一定能形成离子化合物 | |
| B. | 离子键只存在于离子化合物中 | |
| C. | 共价键只存在于共价化合物中 | |
| D. | 离子化合物中必定含有金属元素 |
| A. | 水 | B. | 溴水 | C. | 酚酞溶液 | D. | 石蕊溶液 |
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是元素原子核外电子排步周期性变化的必然结果 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
| A. | 丙烯 | B. | 对二甲苯 | C. | 1-甲基-4-乙基苯 | D. | 1-甲基-2-乙基苯 |