题目内容
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有( )
| A、滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl-、I- |
| B、水电离出来的C (H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| C、在C (H+)=10-13mol/L的溶液:K+、SO42-、Al3+、Cl- |
| D、PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.滴加酚酞试液显红色的溶液为碱性溶液,亚铁离子、铵根离子能够与氢氧根离子反应;
B.水电离出来的c(H+)=10-13mol/L的溶液,该溶液为酸性或者碱性溶液,碳酸氢根离子既能够与氢离子,也能够与氢氧根离子反应;
C.氢离子浓度c(H+)=10-13mol/L的溶液为碱性溶液,铝离子能够与氢氧根离子反应;
D.pH=1的溶液为酸性溶液,Cu2+、Na+、Mg2+、NO3-离子之间不发生反应,也不与氢离子反应.
B.水电离出来的c(H+)=10-13mol/L的溶液,该溶液为酸性或者碱性溶液,碳酸氢根离子既能够与氢离子,也能够与氢氧根离子反应;
C.氢离子浓度c(H+)=10-13mol/L的溶液为碱性溶液,铝离子能够与氢氧根离子反应;
D.pH=1的溶液为酸性溶液,Cu2+、Na+、Mg2+、NO3-离子之间不发生反应,也不与氢离子反应.
解答:
解:A.该溶液为碱性溶液,Fe2+、NH4+能够与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.该溶液为酸性或者碱性溶液,HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.该溶液为酸性溶液该溶液为碱性溶液,Al3+能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Cu2+、Na+、Mg2+、NO3-离子之间不反应,也不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
B.该溶液为酸性或者碱性溶液,HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.该溶液为酸性溶液该溶液为碱性溶液,Al3+能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Cu2+、Na+、Mg2+、NO3-离子之间不反应,也不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列从混合物中分离出其中的一种成分,所采取的分离方法正确的是( )
| A、由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B、水的沸点为100℃,酒精的沸点为78.5℃,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C、四氯化碳和水混合后,可用分液的方法来分离 |
| D、NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
某烃的分子式为C11H16,不能使溴水褪色,但可使酸性高锰酸钾溶液褪色,分子结构中只含有一个烷基,则此烷基的结构共有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列说法正确的是( )
| A、甲苯中混有少量的苯酚可用加入浓溴水过滤除去 |
| B、实验室制硝基苯:在试管中加入1.5mL浓硝酸后逐滴加入2mL浓硫酸混合均匀,冷却到50℃以下,在不断振荡下,逐滴加入1mL苯,并注意避免使混合物的温度超过60℃.塞上带导管的橡皮塞,50℃~60℃水浴加热 |
| C、CH4中含有少量C2H4可通入足量酸性KMnO4溶液除去 |
| D、已烷和水、溴苯和水、二溴乙烷和水都能用分液漏斗分离 |
下列表示对应的离子方程式正确的是( )
| A、硫化钠的水解反应:S2-+H3O+?HS-+H2O |
| B、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| C、向Ba(OH)2溶液滴KHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、Na2HPO4溶于水后发生电离:Na2HPO4=2Na++HPO42- |
下列图示与对应的叙述相符的是( )
A、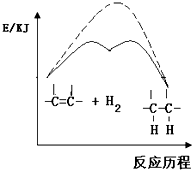 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、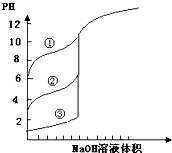 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、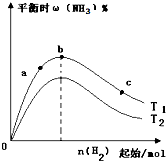 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、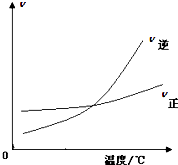 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |

