题目内容
物质的量浓度为2mol/L的硫酸溶液250mL,含硫酸的质量是多少克?
考点:物质的量的相关计算
专题:计算题
分析:根据n=c?V计算硫酸的物质的量,根据n=
计算硫酸的质量.
| m |
| M |
解答:
解:硫酸的物质的量n=c?V=2mol/L×0.25L=0.5mol,硫酸的质量为0.5mol×98g/mol=49g,
答:含硫酸的质量是49g.
答:含硫酸的质量是49g.
点评:本题考查了物质的量的相关计算,难度不大,通过n=c?V和n=
的联合应用即可解答.
| m |
| M |

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
元素性质随着原子序数的递增呈现周期性变化的根本原因的是( )
| A、原子核外电子排布呈周期性变化 |
| B、元素的相对原子质量逐渐增大 |
| C、原子半径呈现从大到小的周期性变化 |
| D、元素化合价呈周期性变化 |
下列说法正确的是( )
| A、甲苯中混有少量的苯酚可用加入浓溴水过滤除去 |
| B、实验室制硝基苯:在试管中加入1.5mL浓硝酸后逐滴加入2mL浓硫酸混合均匀,冷却到50℃以下,在不断振荡下,逐滴加入1mL苯,并注意避免使混合物的温度超过60℃.塞上带导管的橡皮塞,50℃~60℃水浴加热 |
| C、CH4中含有少量C2H4可通入足量酸性KMnO4溶液除去 |
| D、已烷和水、溴苯和水、二溴乙烷和水都能用分液漏斗分离 |
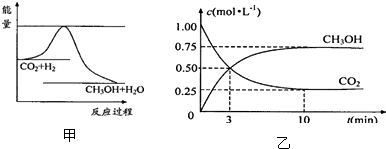
下列图示与对应的叙述相符的是( )
A、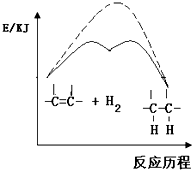 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、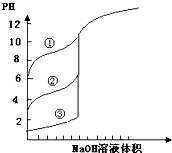 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、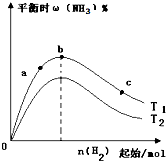 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、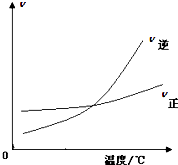 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |

 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: