题目内容
聚合硫酸铁(PFS)是一种新型高效的无机高分子净水剂,它的溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁溶液中SO42-与Fe3+物质的量之比需选用的试剂是( )
| A、NaOH |
| B、FeSO4 |
| C、BaCl2 |
| D、NaClO3 |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:SO42-与BaCl2反应生成沉淀,Fe3+与NaOH反应沉淀,可根据沉淀的质量测定物质的量之比,以此解答该题.
解答:
解:加入NaOH,与Fe3+反应生成氢氧化铁沉淀,可测定Fe3+的量,测定SO42-的物质的量,可加入BaCl2,根据生成硫酸钡的质量测定物质的量,进而测定SO42-与Fe3+物质的量之比,而FeSO4、NaClO3都不反应,不能测定.
故选AC.
故选AC.
点评:本题考查物质的含量的测定,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,根据沉淀的质量测定,难度不大.

练习册系列答案
相关题目
在一定温度,可逆反应N2(g)+3H2(g)?2NH3(g)的平衡常数K=4,由此可以推测在该温度下,可逆反应2NH3(g)?N2(g)+3H2(g)的平衡常数是( )
| A、0.25 | B、2 | C、4 | D、16 |
当碳、氢、氧、氮等元素的相对原子量均取整数时,下列说法正确的是( )
| A、烃及烃的含氧衍生物的相对分子量均为奇数 |
| B、硝基化合物的相对分子量均是偶数 |
| C、烃及烃的含氧衍生物的相对分子量均为偶数 |
| D、酚、醛、氨基酸、酯的相对分子量均为偶数 |
实验室有一瓶久置的K2SO3粉末,为确定其是否变质进行的下述实验结论正确的是( )
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |
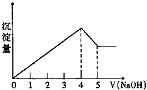 有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)
有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)| A、4:3 | B、4:9 |
| C、8:9 | D、20:27 |
由两金属组成的合金19克,与标况下11.2升氯气恰好完全反应,那么此合金可能是( )
| A、钠和铁 | B、铝和铁 |
| C、铜和钠 | D、银和钠 |