题目内容
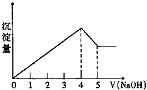 有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)
有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)| A、4:3 | B、4:9 |
| C、8:9 | D、20:27 |
考点:有关混合物反应的计算
专题:计算题
分析:氢氧化钠的体积为0~4时,发生的反应有:Al3++3OH-═Al(OH)3↓,Mg2++2OH-═Mg(OH)2↓,氢氧化钠的体积为4~5时发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O,生成沉淀消耗氢氧化钠溶液体积与氢氧化铝溶解消耗氢氧化钠溶液体积之比为4:1,设溶解氢氧化铝消耗NaOH为1mol,则沉淀最大时消耗NaOH为4mol,计算氢氧化铝物质的量,进而计算氢氧化镁物质的量,再根据原子守恒结合m=nM计算合金中Mg、Al质量之比.
解答:
解:氢氧化钠的体积为0~4时,发生的反应有:Al3++3OH-═Al(OH)3↓,Mg2++2OH-═Mg(OH)2↓,
消耗氢氧化钠的体积为4~5时发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O,
假设氢氧化铝溶解消耗氢氧化钠为1mol,则沉淀最大时消耗NaOH为4mol,
由Al(OH)3+NaOH═NaAlO2+2H2O可知,n[Al(OH)3]=n(NaOH)=1mol,
Al3++3OH-═Al(OH)3↓
3mol 1mol
生成氢氧化镁沉淀消耗NaOH为4mol-3mol=1mol,由Mg2++2OH-═Mg(OH)2↓,可知n[Mg(OH)2]=0.5mol,
由原子守恒知n(Al)=n[Al(OH)3]=1mol,n(Mg)=n[Mg(OH)2]=0.5mol,
故原合金中镁、铝质量之比为0.5mol×24g/mol:1mol×27g/mol=4:9,
故选B.
消耗氢氧化钠的体积为4~5时发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O,
假设氢氧化铝溶解消耗氢氧化钠为1mol,则沉淀最大时消耗NaOH为4mol,
由Al(OH)3+NaOH═NaAlO2+2H2O可知,n[Al(OH)3]=n(NaOH)=1mol,
Al3++3OH-═Al(OH)3↓
3mol 1mol
生成氢氧化镁沉淀消耗NaOH为4mol-3mol=1mol,由Mg2++2OH-═Mg(OH)2↓,可知n[Mg(OH)2]=0.5mol,
由原子守恒知n(Al)=n[Al(OH)3]=1mol,n(Mg)=n[Mg(OH)2]=0.5mol,
故原合金中镁、铝质量之比为0.5mol×24g/mol:1mol×27g/mol=4:9,
故选B.
点评:本题考查混合物的有关计算,明确各阶段发生的反应是解题的关键,注意利用赋值法简化计算.

练习册系列答案
相关题目
下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
| A、Fe(NO3)3、NaOH、CuSO4、KCl |
| B、KCl、AgNO3、HCl、HNO3 |
| C、CuSO4、NaCl、KNO3、BaCl2 |
| D、BaCl2、Na2SO4、Na2CO3、HCl |
聚合硫酸铁(PFS)是一种新型高效的无机高分子净水剂,它的溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁溶液中SO42-与Fe3+物质的量之比需选用的试剂是( )
| A、NaOH |
| B、FeSO4 |
| C、BaCl2 |
| D、NaClO3 |
配制200ml0.1mol/L稀硫酸溶液时,下列实验操作使得所配溶液浓度偏小的是( )
| A、用量筒量取所需的浓硫酸时仰视读数 |
| B、定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 |
| C、定容时,俯视刻度线 |
| D、用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中 |
下列过程需通电后才能进行的是( )
| A、电离 | B、电解 |
| C、电化学腐蚀 | D、金属的化学腐蚀 |
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4 如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是:
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是: